- Accueil
- Volume 75 (2022)
- Diversité des pucerons et de leurs ennemis naturels en cultures sous serre à Tizi-Ouzou, Algérie
Visualisation(s): 1716 (16 ULiège)
Téléchargement(s): 2 (0 ULiège)
Diversité des pucerons et de leurs ennemis naturels en cultures sous serre à Tizi-Ouzou, Algérie

Document(s) associé(s)
Version PDF originaleRésumé
Les pucerons sont considérés parmi les ravageurs les plus redoutables aux plantes en raison des dégâts sévères qu’ils peuvent occasionner en agriculture, horticulture et sylviculture. L’étude porte sur la diversité, l’abondance des pucerons et des insectes auxiliaires aphidiphages en cultures sous serre de piment, de tomate et d’aubergine dans la région de Tizi-Ouzou (Algérie). Un total de 606 pucerons ailés représentant 26 espèces a été capturé à l’aide de pièges jaunes. Une importante diversité est notée pour la culture de piment variété Biskra avec dix huit espèces aphidiennes recensées. Quinze, quatorze et douze espèces aphidiennes ont été observées respectivement dans la culture d’aubergine, de piment variété Joker et de tomate. Cette étude a également permis de capturer le puceron de la menthe Eucarazzia elegans pour la deuxième fois en Algérie dans la culture de tomate. Quatorze espèces d’ennemis naturels ont été identifiées parmi lesquelles les coccinelles sont les plus présentes dans les quatre cultures, suivies des syrphes, des parasitoïdes et des chrysopes avec des effectifs moindres. Les parasitoïdes primaires sont représentés par quatre espèces, il s’agit de Lysiphlebus testaceipes, Diaeretiella rapae, Aphidius ervi et Aphidius colemani. L’étude a révélé également la présence de trois espèces d’hyperparasitoïdes, il s’agit d’Alloxysta victrix, Dendrocerus carpenteri et Dendrocerus sp. Cette étude qui est une première investigation en Algérie sur les pucerons et leurs ennemis naturels sur les cultures de solanacées (piment, tomate et aubergine) a permis d’obtenir des résultats intéressants.
Abstract
Aphids are considered among the most pests of plants because they can cause severe damage in agriculture, horticulture and forestry.The study on the diversity and abundance of aphids and aphidiphagous insects in pepper, tomato and eggplant crops grown under greenhouse conditions was performed in the province of Tizi-Ouzou (Algeria). A total of 606 winged aphids were trapped representing 26 species. An important diversity was noted for the pepper crop of Biskra variety with eighteen aphid species recorded. Fifteen, fourteen and twelve aphid species were observed in eggplant, pepper Joker variety and in the tomato crops respectively. This study also allowed the catching of the mint aphid Eucarazzia elegans for the second time in Algeria in the tomato greenhouse. Fourteen species of natural enemies were also identified. Ladybugs were the most captured in the four greenhouses, followed by hoverflies, parasitoids and lacewings with only a few individuals. The primary parasitoids were represented by four species, namely Lysiphlebus testaceipes, Diaeretiella rapae, Aphidius ervi and Aphidius colemani. The survey also revealed the presence of two species of hyper parasitoids; namely Alloxysta victrix, Dendrocerus carpenteri and Dendrocerus sp. This study, is a first investigation in Algeria on aphids and their natural enemies on solanaceous crops (pepper, tomato and eggplant), has provided interesting results
Table des matières
Reçu le 10 août 2021 , accepté le 20 janvier 2022
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr).
INTRODUCTION
1Parmi les angiospermes, la famille des Solanaceae par sa diversité en espèces cultivées est la plus importante pour l’alimentation humaine (Hawkes, 1999). Cette famille comporte 98 genres et environ 2700 espèces dont environ la moitié appartient au genre Solanum (Lou et al., 2010). Selon Daunay et Lester (1989), cette famille inclue plusieurs plantes alimentaires économiquement importantes comme la pomme de terre, la tomate, le piment, l’aubergine et d’autres moins connues telle que le Pepino (Solanum muricatum Aiton.) ainsi que le tabac Nicotiana tabacum L. et d’autres espèces utilisées à des fins pharmaceutiques ou ornementales. Plusieurs ravageurs peuvent nuire à ces plantes durant le cycle végétatif, notamment les pucerons. Ces derniers appartiennent à la famille des Aphididae et constituent un groupe d’insectes extrêmement répandu. Plus de 4700 espèces sont recensées dans le monde (Remaudière & Remaudière, 1997), dont environ 450 sont identifiées sur des plantes cultivées (Blackman & Eastop, : 2000). Les pucerons sont des insectes piqueurs-suceurs qui se nourrissent de sève, ce qui entraine un affaiblissement des plantes. En plus des dégâts directs, les pucerons peuvent indirectement nuire à leurs plantes hôtes par la production de miellat, qui réduit la valeur marchande des récoltes (Torres-Quintero et al., 2013). Sur le miellat aphidien excrété se développe des fumagines notamment celles du genre Cladosporium et Aureobasidium qui sont des champignons qui diminuent la photosynthèse, et obstruent les stomates des feuilles réduisant ainsi la régularité des processus respiratoires des plantes (Capinera, 2001). Les pucerons peuvent également transmettre des virus aux cultures (Torres-Quintero et al., 2013 ; Bosquee et al., 2018). En Algérie, la lutte chimique reste la principale méthode de lutte contre les pucerons. L’utilisation excessive d’insecticides de synthèse entraîne plusieurs effets secondaires, notamment une résistance aux insecticides et des effets nocifs sur les organismes utiles (Bass et al., 2014 ; Jordan et al., 2020). Les pucerons peuvent être contrôlés naturellement par divers ennemis naturels (Lu et al., 2012). Plusieurs insectes prédateurs, principalement les coccinelles (Coleoptera : Coccinellidae), les chrysopes (Neuroptera: Chrysopidae), les syrphes (Diptera : Syrphidae) sont efficaces ainsi que les parasitoïdes (Hymenoptera : Braconidae). Chez les coccinelles, les larves et les adultes sont aphidiphages et peuvent s’alimenter de plusieurs espèces de pucerons (Dixon, 2000). Les syrphes et les chrysopes sont aphidiphages uniquement au stade larvaire, par contre les adultes sont floricoles (San Martin, 2004). Toutes les espèces de la famille des Braconidae, sous-famille des Aphidiinae sont des endo-parasitoïdes solitaires des pucerons (Völkl et al., 2007) et jouent un rôle très important dans la régulation des populations de ces ravageurs dans des programmes de lutte biologique (Powell & Pell, 2007). Cette étude a pour objectif de déterminer la diversité des pucerons et des auxiliaires aphidiphages associés aux cultures de piment, d’aubergine et de tomate cultivées sous serre dans la région de Tizi-Ouzou (Algérie).
MATÉRIELS ET MÉTHODES
Région d’étude
2La région de Tizi-Ouzou (Algérie) est située au Nord Algérie, le climat de la région est classé comme Csa (climat tempéré chaud avec été sec et chaud) (Köppen et al., 2011). Le site expérimental se situe à 73 m d’altitude, (Latitude : 36°42'40.69"N, Longitude : 4° 6'38.08"E). L’échantillonnage est mené sur trois cultures (piment, tomate et aubergine) et dans 4 serres dont la surface de chacune est de 320 m2. Deux serres de piment, avec deux variétés Joker et Biskra, une parcelle de tomate de variété Kawa et une parcelle d’aubergine variété Adria.
Piégeage des pucerons ailés et des ennemis naturels
3Pour effectuer cette étude, chaque serre a été divisée en 9 blocs. Au milieu de chacun, un piège Von Moerik jaune (ϴ :27 cm, h : 10 cm) est placé et rempli d'eau avec quelques gouttes de détergent. D’après Yattara et al. (2013), les pucerons sont connus pour leur attirance par la couleur jaune. Une fois par semaine, les insectes capturés dans les pièges jaunes sont retirés à l'aide d'un pinceau fin et conservés dans des tubes à essai remplis d'éthanol à 70%. Le changement du contenu du récipient est nécessaire pour un rendement optimal (EDES, 2011). Les autres ennemis naturels des pucerons sont mis dans des boites de pétri.
Observations directes des pucerons aptères et des ennemis naturels sur les feuilles
4Les pucerons observés sur les feuilles des Solanaceae sont collectés une fois par semaine, à raison d’une plante par bloc. Le prélèvement est réalisé à l'aide d'un pinceau fin et les échantillons sont mis dans un tube rempli d'éthanol à 70%. Les pucerons parasités et les prédateurs aphidiphages sont mis dans des boites de pétri.
5Les pucerons piégés et prélevés sur les plantes sont triés puis identifiés sur la base des clés d'identification de Stroyan (1961), Jacky & Bouchery (1982), Autrique & Ntahimpera (1994), Remaudière et al. (1985), Leclant (1999) et Blackman & Eastop (2000, 2006).
6La détermination des syrphes est effectuée à l’aide des clés d’identification de Stubbs et Falk (1983), Verlinden (1994) et Speight (2015). Les micro-hyménoptères sont identifiés à l’aide des clés de détermination de Stary (1970, 1979); Kavallieratos et al. (2001); Tomanovic et al. (2003); Rakhshani et al. (2005, 2006); Rakhshani et al. (2007, 2008) ; Talebi et al. (2009).
Exploitation des résultats
7Dans cette étude, les indices de composition (la fréquence centésimale) et de structure (Shannon et l'équitabilité E) sont exploités. La richesse spécifique aphidienne est analysée en calculant les abondances relatives des différentes espèces selon Dajoz (2006) :
8F(%) = ni x 100/N
9ni : Le nombre des individus de l’espèce prise en considération.
10N : Le nombre total des individus de toutes les espèces confondues.
11L’indice de diversité de Shannon varie en fonction du nombre d'espèces présentes et l'abondance de chacune d'entre elles (Barbault, 2008). Il est calculé à l'aide de la formule suivante :
12H'= - Σ qi log2 qi
13H' : Indice de diversité de Shannon exprimé en unités binaires.
14qi: Probabilité d'occurrence de l'espèce (qi= ni/N, où ni : est le nombre d'espèces dans l'échantillon et le nombre d'individus, et N est la somme des ni de toutes les espèces combinées).
15Log2 : logarithme - base 2.
16L’indice d'équitabilité (E) considère la relation entre les diversités réelle et théorique maximale (Blondel, 1975) selon la formule suivante :
17E = H' / H' max.
18H' : est l'indice de diversité de Shannon exprimé en bits.
19H' max : est l'indice de diversité maximale exprimée en bits, avec
20H' max= Log2S
21S : est la richesse totale correspondant au nombre d'espèces présentes.
RÉSULTATS
22Le piégeage des pucerons ailés à l’aide des pièges jaunes installés dans trois cultures (piment, tomate et aubergine) a permis de dresser une liste de 26 espèces (Tableau 1). Ces espèces appartiennent aux sous-familles des Aphidinae, des Chaitophorinae et des Eriosomatinae réparties en 4 tribus et 17 genres.
23La sous-famille la plus abondante est celle des Aphidinae et regroupe deux tribus : les Aphidini et les Macrosiphini. Cette dernière est dominante. Dans la parcelle de piments variété Biskra, 18 espèces de pucerons ont été piégées. Elles appartiennent à 11 genres, 4 tribus et 3 sous-familles. Dans la variété Joker, 14 espèces sont recensées appartenant à 11 genres, 3 tribus et 3 sous-familles. Dans la serre d’aubergines, 15 espèces sont observées. Ces espèces sont réparties en 10 genres, 3 tribus et trois sous-familles. Dans la serre de tomates, 12 espèces sont capturées dans les pièges jaunes, appartenant à 7 genres, 2 tribus et 2 sous-familles.
Tableau 1 : Diversité des pucerons recensés à l’aide des pièges jaunes dans les quatre cultures investiguées.
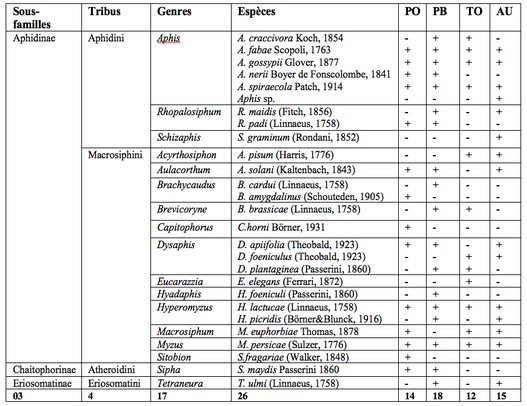
PO : Piment variété Joker ; PB : Piment variété Biskra ; TO : Tomate ; AU : Aubergine
24Durant la période d’échantillonnage, 606 individus ont été collectés à l’aide des pièges jaunes installés dans les quatre serres. L’abondance relative de ces espèces varie selon la culture : 26,1%, 22,4% et 19,2% des collectes de M. persicae respectivement dans les deux serres de piment (variété Joker et Biskra) et d’aubergine (Tableau 2). Au niveau de la culture de tomates, A. spiraecola a été dominant avec 23 individus soit une fréquence de 31,4%. Cette étude a également révélé la présence d’E. elegans pour la deuxième fois en Algérie. Un seul individu femelle ailé a été capturé durant la période de piégeage. Cet ailé a été collecté le 13 mai 2019. Le spécimen identifié est déposé dans la collection d’insectes du laboratoire de production, amélioration et protection des végétaux, Département de Biologie, Université Mouloud Mammeri de Tizi-Ouzou (DZA).
Tableau 2 : Diversité et abondance relative de l’ensemble des espèces capturées à l’aide des pièges jaunes installés dans les quatre serres d’étude.
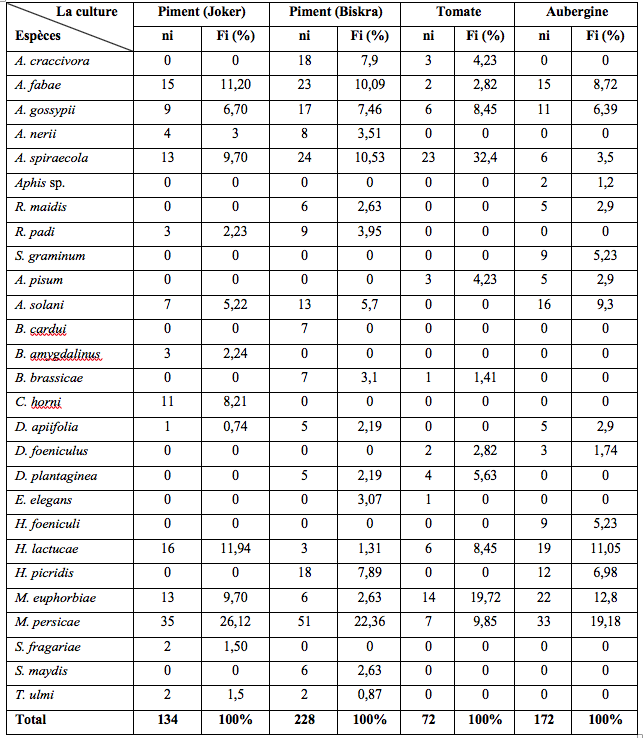
ni : Nombre d’individus ; Fi % : Abondances relatives
25L'indice de diversité de Shannon varie entre 2,38 et 3,71, étant le plus élevé au niveau des parcelles de piments variété Biskra et d’aubergines avec des valeurs respectivement de 3,71 et 3,69 (Figure 1). La diversité maximale H' max varie entre 4,17 et 5,58 pour toutes les cultures. L'équitabilité obtenue tend vers 1 au niveau des 4 cultures cultivées ce qui correspond à un équilibre entre les espèces aphidiennes.
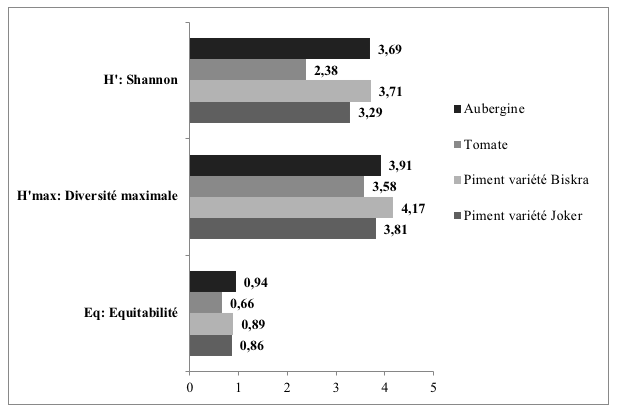
Figure 1 : Valeurs de l’indice de Shannon calculés pour les espèces aphidiennes piégées dans chaque parcelle cultivée.
26Les insectes auxiliaires recensés représentent un effectif moins important que les pucerons : 222 individus ont été piégés dans les quatre serres représentant 12 espèces, 6 familles et 4 ordres. Les coccinelles sont les plus abondantes, suivies des syrphes, des micro-hyménoptères braconides et des chrysopes avec quelques individus seulement (Tableau 3). La parcelle de piments, variété Biskra, correspond à l’abondance et la diversité la plus élevée avec 96 individus et 10 espèces.
Tableau 3 : Diversité, abondance et proportions relatives des auxiliaires aphidiphages capturés à l’aide des pièges jaunes installés dans les quatre serres.
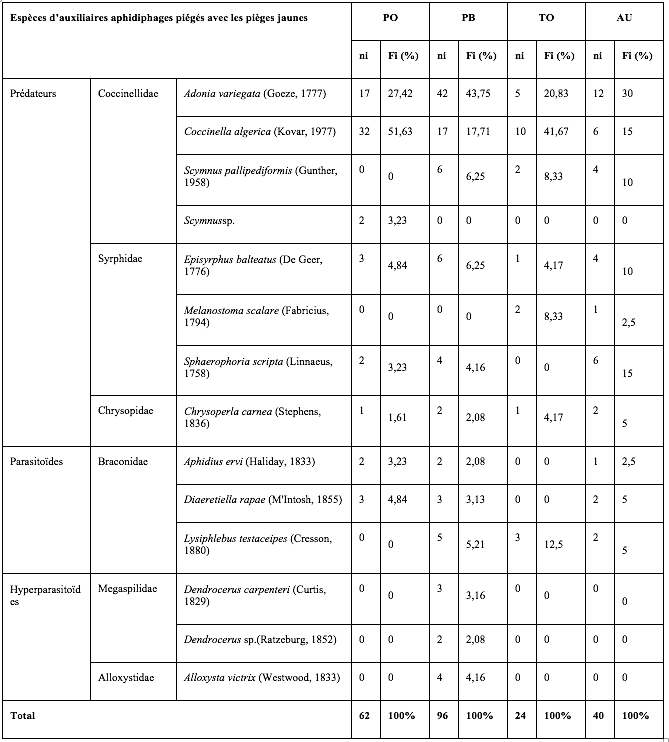
PO : Piment Variété Joker ; PB : Piment Variété Biskra ; TO : Tomate ; AU : Aubergine.
ni : Nombre d’individus ; Fi% : Abondances relatives.
27Les observations directes sur les feuilles ont permis de dresser une liste de 12 espèces d’ennemis naturels des pucerons, toutes observées sur le piment variété Biskra. Une diversité restreinte d’espèces auxiliaires a été observée pour les cultures de tomates et d’aubergines, avec respectivement 7 et 4 espèces. Les coccinelles sont les prédateurs les plus abondants, l’espèce C. algerica étant la plus présente suivie par les Syrphidae. La proportion relative des chrysopes est la plus élevée sur tomates avec 8,8% des insectes collectés. Cette famille étant exclusivement représentée par l’espèce C. carnea (Tableau 4).
Tableau 4 : Diversité et proportions relatives des auxiliaires aphidiphrages observés sur les plantes des Solanaceae cultivées sous serres.
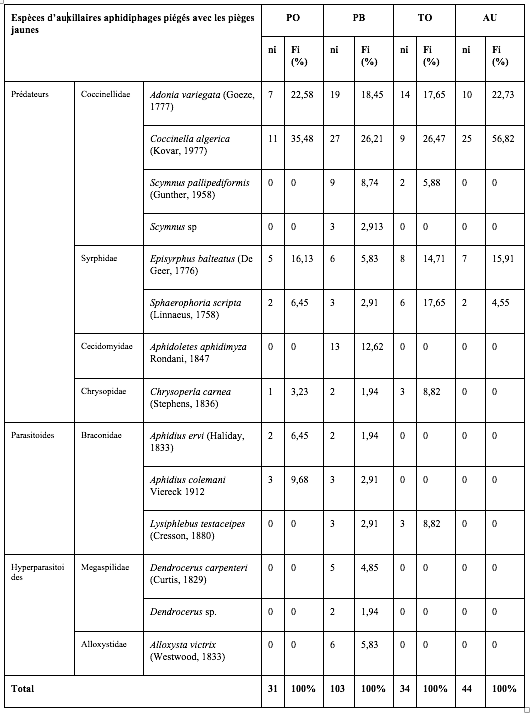
PO : Piment Variété Joker ; PB : Piment Variété Biskra ; TO : Tomate ; AU : Aubergine.
ni : Nombre d’individus ; Fi% : Abondances relatives.
DISCUSSION
28L’analyse de la composition du peuplement d’Aphididae révèle l’existence de 26 espèces de pucerons capturées dans l’ensemble des quatre serres. Ait Amar et Benoufella-Kitous (2021) sur pomme de terre cultivée en plein champs dans trois régions de Tizi-Ouzou ont recensé 24 espèces dans la région d’Aghribs, 30 espèces dans la région de Tizi-Rached et 55 espèces à Tizi-Ouzou ville. Dans une autre étude dans la région de Makouda (Tizi-Ouzou, Algérie), Ait Amar et al. (2021) signalent la présence de 48 espèces sur pomme de terre. Nos résultats sont également proches de ceux de Benoufella-Kitous et al. (2019) dans leur étude sur les pucerons des légumineuses alimentaires dans la région de Tizi-Ouzou, qui ont recensé 30 espèces de pucerons dans la parcelle de pois chiche, 29 espèces dans la parcelle de lentille, 21 espèces dans la parcelle de petit pois et 16 espèces dans celle de la fève. La différence dans la richesse des espèces aphidiennes recensées dans les quatre serres peut être expliquée par les différences de la culture d’une part, et d’autre part par la richesse floristique des espèces qui a une conséquence directe sur la richesse des espèces aphidiennes. En effet, une diversité des plantes adventices est notée aux alentours de la culture du piment variété Biskra par rapport aux autres serres. De même, cette serre est biologique car aucun traitement chimique et aucun désherbage n’ont été effectués. Remaudière et Autrique (1984) ont signalé que les plantes sauvages sont la source des pucerons ailés qui s’installent dans les cultures. Selon Hullé et al. (1999), de nombreuses familles végétales très différentes les unes des autres peuvent héberger de nombreuses espèces aphidiennes. La dominance de M. persicae dans les pièges installés dans les deux serres de piment et d’aubergine peut s’expliquer par la présence de son hôte secondaire, à savoir ces deux espèces cultivées. Ce qui est confirmé par Hullé et al. (1999) et Blackman et Eastop (2000 ; 2006).
29Plusieurs espèces de pucerons des Poaceae ont été capturées dans les pièges jaunes, la présence de ces espèces (R. maidis, R. padi, S. graminum, S. fragariae et S. maydis) est liée directement à la présence de leurs hôtes aux alentours et à l’intérieur des serres, tels que l’orge queue-de-rat, le maïs, le blé, l’avoine, le seigle, le sorgho, le chiendent pied de poule et le panicum. Ces espèces aphidennes de céréales ont été signalées par Bouabida et al. (2020) dans la région de Boumerdès (Algérie). Les espèces R. maidis, R. padi, S. fragariae et S. maydis ont été également signalées par Ait Amar et Benoufella-Kitous (2021) dans le cadre d’une étude en culture de la pomme de terre dans 3 localités situées dans la région de Tizi-Ouzou.
30A. fabae A. craccivora et A. gossypii sont des espèces extrêmement polyphages (Blakman & Eastop, 2000) qui ont une préférence pour la famille des Fabaceae (Leclant, 1999). Leur présence peut s’expliquer d’une part par la présence de leurs hôtes secondaires tels que les pois, la fève et le haricot. Ces cultures sont cultivées sur de grandes superficies dans le site d’échantillonnage. Ces trois espèces aphidiennes sont observées sur les plantes de plusieurs espèces de légumineuses alimentaires dans la région de Tizi-Ouzou (Benoufella-Kitous et al., 2019). D’autre part, la présence de ces trois espèces peut également s’expliquer par le fait qu’ils peuvent attaquer les plantes appartenant à la famille des Solanaceae (Hullé et al., Leclant, 1999 ; Blakman et Eastop, 2000), qui est très cultivée dans la région d’étude. L’espèce H. lactucae est observée dans les quatre serres investiguées. Cette espèce très polyphage a pour hôtes primaires les groseilliers qui sont des arbustes de la famille des Grossulariaceae et a pour hôtes secondaires les Asteraceae (Blakcman & Eastop, 2000). Cette dernière famille est représentée dans le site d’échantillonnage par plusieurs espèces telles que Sonchus oleraceus, S. asper, S. arvensis, Lactuca sativa et Calendula arvensis.
31Dans la présente étude, le puceron de la menthe E. elegans a été piégé pour la première fois dans la région d’Oued-Aïssi dans une serre de tomates. C’est la deuxième fois que cette espèce est inventoriée en Algérie, plus précisément dans la région de Tizi-Ouzou. La première observation a été réalisée par Benoufella-Kitous et Medjdoub (2016) dans la région de Tala Amara (Tizi-Ouzou, Algérie). En Turquie, cette espèce a aussi été observée à Bornova et Menemen sur la sauge (Zarkani et al., 2017). Au Brésil, à São Carlos, elle a été signalée pour la première fois par Peronti et al. (2002), sur une plante ornementale (Salvia splendens) en 1997. En Argentine, E. elegans a été recensée pour la première fois par Ortego en 1994 sur Lavandula sp. Au Moyen Orient, cette espèce est recensée par Hussain et al (2015), pour la première fois en Arabie Saoudite sur Lavandula pubescens.
32Comme le cycle aphidien dépend des conditions environnementales (Dixon, 1998 ; Wieczorek, 2013), la présence d’E. elegans dans la serre de tomates peut être expliquée par la présence de plantes herbacées, appartenant à la famille des Lamiaceae, telles que la menthe, la lavande et la sauge, aux alentours de la serre. Le recensement de cette espèce à la date du 13 mai peut également s’expliquer par les facteurs climatiques : les températures moyennes maximales enregistrées en ce mois étaient de l’ordre de 26,3°C. Hazell et al. (2010) et Brabec et al. (2014) ont affirmé que les températures élevées permettent aux populations de cette espèce d’augmenter et de s’étendre. E. elegans est une espèce tempérée qui est active et qui se développe plus rapidement à basses températures que les espèces tropicales (Stoetzel, 1985 ; Wieczorek & Chlond, 2019). Le puceron de la menthe a été observé pour la première fois par Zarkani et Turanli (2019), à Izmir en Turquie au printemps. Ces auteurs ont noté que ce puceron s’est développé pendant le mois d’avril sur sa plante hôte et se déplace vers d’autres plantes hôtes sous forme ailée. Avant la date d’enregistrement d’E. elegans dans la serre d’étude, la toile plastic couvrant cette dernière a été légèrement enlevé à chaque extrémité pour diminuer l’humidité dans la serre. Ceci a probablement favorisé l’entrée d’insectes dont les pucerons. Wieczorek et Chlond (2019) ont affirmé que dans le cadre de l'aéroplancton, les pucerons ailés, se propagent facilement sur de longues distances. C'est pourquoi les ailés d'E. elegans sont pris dans divers types de pièges.
33Le calcul de l’indice de diversité de Shannon varie entre 2,38 et 3,71. Les valeurs les plus importantes ont été enregistrées au niveau des parcelles de piments variété Biskra et d’aubergines. Nos résultats sont proches de ceux de Bouabida et al. (2020) qui ont noté une valeur qui varie entre 3,66 et 4,38. L'équitabilité obtenue tend vers 1 pour les 4 cultures. Cela indique que les nombres d'espèces présentes tendent à être en équilibre les uns avec les autres en lien avec l'environnement proche du champ des cultures (Francis et al., 2001).
34En terme d’abondance, nos collectes sont similaires à celles de Lopes et al. (2014) dans leur étude sur l’effet de deux associations culturales en Chine. Ces auteurs ont piégé 200 individus d’auxiliaires à l’aide des pièges jaunes installés dans une parcelle de blé et de pois. Aussi, dans une étude similaire réalisée sur pomme de terre à Tizi-Ouzou (Algérie) par Ait Amar et al. (2020), 10 espèces aphidiphages ont été identifiées. Dans une autre étude effectuée sur deux cultures, bananiers et tomates au Congo par Lofinda Lifake et al. (2018), 12 espèces aphidiphages ont été également recensées. De nos résultats, il ressort que les coccinelles sont les prédateurs les plus abondants. Ces résultats sont en accord avec une étude menée dans l’Est de la Chine par Lopes et al. (2012) sur des cultures maraichères. Ils sont également en accord avec les résultats obtenus par Francis et al. (2001) en Belgique dans des cultures de fèves, qui ont mis en évidence le caractère dominant de la famille des Coccinellidae. Quant aux chrysopes, Lopes et al. (2012) ont identifié une seule espèce de la famille des Chrysopidae qui se développe sur pomme de terre, C. carnea.
35Les abondances relatives des syrphes recensés sur les feuilles des quatre cultures sont en accord avec ceux d’Ait Amar et al. (2020) qui ont noté la présence des syrphes avec une abondance de 27% dans une parcelle de pomme de terre située dans la région de Tizi-Ouzou. Les coccinelles observées sur les feuilles de piments variété Biskra et sur les feuilles de la tomates représentent des abondances de 44,6% et 44,1% resoectivement Ces résultats corroborent ceux de Lopes et al. (2020) qui signalent la présence des coccinelles avec une abondance de 39,3% en pomme de terre en Chine.
36L’inventaire des parasitoïdes effectué montre l’existence de 4 espèces : A. ervi, D. rapae, L. testecieps et A. colemani. Ces espèces ont été recensées dans l’Est Algérien par Laamari et al. (2011) dans des cultures et en milieu naturel et par Ben Halima-Kamel et Ben Hamouda (1993) en Tunisie sur des cultures sous serre. Dans la région de Tizi-Ouzou, Ait Amar et al. (2020) ont noté la présence des deux premières espèces dans une parcelle de pomme de terre. En Chine, sur pomme de terre et courgette, Lopes et al. (2012) ont souligné la présence de D. rapae dans ces deux cultures.
CONCLUSIONS
37L’étude préliminaire menée sur les pucerons des Solanaceae cultivées sous serre dans la région de Tizi-Ouzou a révèlé l’existence de 26 espèces, dont E. elegans enregistrée pour la deuxième fois en Algérie. Cette étude a également révélé l’existence de 14 espèces d’ennemis naturels aphidiphages, dont 8 espèces prédatrices, 4 espèces parasitoïdes primaires des pucerons et trois espèces d’hyperparasïtoides. Les Coccinellidae sont les plus dominantes parmi les ennemis naturels des aphides. Il serait intéressant de poursuivre plusieurs études dans différentes régions afin d'identifier les plantes hôtes de chaque espèce de puceron.
Bibliographie
Ait Amar S., Benoufella-Kitous K. & Tahar Chaouche S., 2020. Potato Aphids and Their Natural Enemies in Tizi-Ouzou Northern of Algeria: Biodiversity and Importance. Bulletin of Pure and Applied Sciences, 39, 75-81. https://doi:10.5958/2320-3188.2020.00009.1
Ait Amar S. & Benoufella-Kitous K., 2021. Diversity of aphids (Hemiptera: Aphididae) associated with potato crop in Tizi-Ouzou (North of Algeria), with new records. Acta Agriculturae Slovenica, 117 (1), 1-9. https://doi:10.14720/aas.2021.117.1.1768
Ait Amar S., Benoufella-Kitous K. & Medjdoub-Bensaad F., 2021. Aphid Survey Reveals the First Record of the Bramble Aphid Aphis ruborum (Börner & Schilder, 1931) (Hemiptera: Aphididae) in Algeria, and a Second Report for Africa After 59 Years. African Entomology, 29 (2), 649-657. https://doi.org/10.4001/003.029.0649
Autrique A. & Ntahimpera L., 1994. Atlas des principales espèces de pucerons rencontrées en Afrique Sub-saharienne. Administration Générale de la Coopération au Développement, AGCD, 78 p.
Barbault R., 2008. Ecologie générale : structure et fonctionnement de la biosphère. 6 Editions. Edition Dunod: Paris, 390p.
Bass C., Puinean A.M., Zimmer C.T., Denholm I., Field L.M., Foster S.P., Gutbrod, O., Nauen, R., Slater R. & Williamson M.S., 2014. The evolution of insecticide resistance in the peach potato aphid, Myzus persicae. Insect Biochemistry and Molecular Biology, 51, 41-51.
Ben Halima-Kamel M. & Ben Hamouda M. H., 1993. Les pucerons des cultures protégées et leurs ennemis naturels. Tropicultura, 11(2), 50-53.
Benoufella-Kitous K. & Medjdoub-Bensaad F., 2016. Aphid’s diversity in chickpea (Cicer arietinum) and lentil (Lens culinaris) cultures within Tala Amara region (Tizi-Ouzou, Algeria). Advances in Environmental Biology, 10(8), 19-29.
Benoufella-Kitous K., Medjdoub-Bensaad F. & Kheloul L., 2019. Diversité des pucerons des légumineuses alimentaires dans la région de Tizi-Ouzou. Entomologie faunistique-Faunistic entomology,72, 5-12.
Blackman R.L. & Eastop V.F., 2019. Aphids of the world’s plants: an online identification and information guide. -[online] URL: (accessed May 30, 2019).
Blackman R.L. & Eastop V.F., 2000. Aphids on the World’s Crops. An Identification and Information Guide. The Natural History Museum: London U.K, 466p.
Blackman, R.L. & Eastop V.F. 2006. Aphids on the World's Herbaceous Plants and Shrubs. (Limited JWS edition.), The Natural History Museum: London U.K, 1439p.
Blondel J., 1975. L’analyse des peuplements d’oiseau. - Eléments d’un diagnostic écologique. La méthode des échantillonnages fréquentiels progressifs (E.F.P.). Revue d’Écologie (terre et vie), 29(4), 533-589.
Bosquee E., Boullis A., Bertaux M., Francis F. & Verheggen F.J., 2018. Dispersion of Myzus persicae and transmission of potato virus Y under elevated CO2 atmosphere. Entomologia Experimentalis et Applicata, 166, 380-385.
Bouabida N., Benoufella-Kitous K., Ait Amar S. & Medjdoub-Bensaad F., 2020. Aphid diversity in two food legume crops: fava bean and pea in Naciria region, and first record of Melanaphis sacchari (Zehntner, 1897) in Algeria. Journal of Entomological and Acarological Research, 52,(9503), 54-60. https://doi:10.4081/jear.2020.9503
Brabec M., Honěk A., Pekár S. & Martinková Z., 2014. Population dynamics of aphids on cereals: Digging in the time-series data to reveal population regulation caused by temperature. PLoSONE, 9(9), 1-8.
Capinera J.L., 2001. Handbook of Vegetable Pests. San Diego, CA, USA: Academic Press, 800p
Dajoz R., 2006. Précis d’écologie. Dunod, :Paris, 630p.
Daunay M.C. & Lester R.N., 1989. The usefulness of taxonomy for Solanaceae breeders, with special référence to the genus Solanum and to Solanum melongena L. (eggplant). Capsicum Newslett, 7:10.
Dixon A.F.G., 1998. Aphid ecology. An optimization approach.- Chapman and Hall, London, UK, 300 pp.
Dixon A.F.G., 2000. Insect Predator-Prey Dynamics: Ladybird Beetles and Biological Control. Cambridge University Press : Cambridge, 268p.
EDES 2012., Méthodes d’observation et d’échantillonnage au champ des populations de ravageurs. Surveillance et contrôle des bio-agresseurs dans les cultures. Cahier technique R.5 : 29.
Francis F., Colignon P., Hastir P., Haubruge E. & Gaspar C., 2001. Evaluation of aphidophagous ladybird populations in a vegetable crop and implications as biological control. Medical Faculty Landbouw University Gent, 66, 333-340.
Hawkes J.G., 1999. The economic importance of the family Solanaceae. In: Nee, M., Symon, D.E., Lester, R.N. & Jessop, J.P., eds. Solanaceae IV: Advances in Biology and Utilization. Royal Botanic Gardens: Kew, UK, 1-8.
Hazell S.P. Groutides C., Neve B. P., Blackburn T. M., and Bale J.S., 2010. A comparison of low temperature tolerance traits between closely related aphids from the tropics, temperate zone, and Arctic. Journal of Insect Physiology, 56, 115-122. https://doi.org/10.1016/j.jinsphys.2009.08.020
Hullé M., Ighil E.T.A., Robert Y., Monnet Y. 1999. Les pucerons des plantes maraîchères. Cycles biologiques et activités de vol. Institut National Recherche Agronomique, Paris. 136 pp.
Hussain S., Aldryhim Y. Al-Dhafer H., Halbert S. & Thomas J., 2015. New aphid records for Saudi Arabia (Hemiptera : Aphidoidea). Zoology in the Middle East, 61(4), 368-371. https://doi.org/10.1080/09397140.2015.1101927
Jordan M.O., Sauge M. H., Vercambre G., 2020. Chemical and growth traits of the peach tree may induce higher infestation rates of the green peach aphid, Myzus persicae (Sulzer). Pest Management Science, 76 : 797-806.
Kavallieratos N.G., Lykouressis D.P., Sarlis G.P., Stathasgl G.J., Sanchis S.A. & Athanassiou C.G., 2001. The Aphidiinae (Hymenoptera: Ichneumonoidea: Braconidae) of Greece. Phytoparasitica, 29 (4), 306-340.
Köppen W., Volken E. & Brönnimann S. 2011. The thermal zones of the earth according to the duration of hot, moderate and cold periods and to the impact of heat on the organic world (Translated from: Die Wärmezonen der Erde, nach der Dauer der heissen, gemässigten und kaltenZeit und nach der WirkungderWärme auf die organische Welt betrachtet, Meteorol Z 1884 (1), 215-226. Meteorologische Zeitschrift. 20 (3), 351-360
Laamari M., Tahar Chaouche S., Benferhat S., Abbes S.B., Merouani H., GhodbaneS., Khenissa N. & Stary P., 2011. Interactions tritrophiques : plante-puceron-hyménoptère parasitoïde observées en milieux naturels et cultivés de l’Est algérien. Entomologie faunistique- Faunistic Entomology, 63 (3), 115-120.
Leclant F., 1999. Les pucerons des plantes cultivées. Clefs d’identification. II. Cultures maraîchères. ACTA/INRA, 98p.
Lofinda Lifake M., Monde Te Kazanbga G. & Hance T., 2018.Évaluation de la diversité des Aphididae et leurs ennemis naturels en culture de bananier à proximité de plantes de bordure. Revue Marocaine des Sciences Agronomiques et Vétérinaires, 6(4), 575-580.
Lopes T., Bosquée Honba D., Serteyn L., Chen J., Yong L. & Francis F., 2014. Effets de deux associations culturales à base de blé sur les populations de pucerons (Homoptera: Aphididae) et d’auxiliaires aphidiphages: étude préliminaire menée en Chine. Entomologie Faunistique – Faunistic Entomology, 67, 213-219
Lopes T., Bosquée E., Polo Lozano D., Chen J.L., Deng Fa C., Yong L., Fang-Qiang Z., Haubruge E., Bragard C. & Francis F., 2012.Evaluation de la diversité des pucerons et deleurs ennemis naturels en cultures maraîchères dans l’est la Chine. Entomologie Faunistique – FaunisticEntomology, 64(3), 63-71.
Lou Q., Iovene M., Spooner D.M., Buell C.R. & Jiang J., 2010. Evolution of chromosome 6 of Solanum species revealed by comparative fluorescence in situ hybridization mapping. Chromosoma, 119, 435-442 http://dx.doi.org/10.1007/s00412-010-0269-6
Lu Y.H., Wu K.M., Jiang Y.Y., Guo Y.Y., & Desneux N., 2012. Widespread adoption of Bt cotton and insecticide decrease promotes biocontrol services. Nature, 487, 362-365.http://dx.doi.org/10.1038/nature11153
Nampeera E.L., Blodgett S., O’Neal M.E., Nonnecke G.R., Murungi L.K., Abukutsa-Onyango M.O., & Wesonga J.M., 2020. Resistance of Amaranthus spp. to the green peach aphid (Hemiptera: Aphididae). Journal of Economic Entomology,113, 1299-1306.
Paulian M., 1999. Les Chrysopes, auxiliaires contre des insectes divers. Phytoma, 522, 41-46.
Peronti, A.L. & Sousa-Silva C. R., 2002.Aphids (Hemiptera: Aphidoidea) of ornamental plants from São Carlos, São Paulo state, Brazil. Revista de Biología Tropical, 50(1), 137-144.
Powell W. & Pell J.K., 2007. Biological Control. In: Van Emden H.F. & Harrington R, eds. Aphids as Crop Pests. CAB International: Cambridge Massachusetts, 469-499.
Rakhshani E., Talebi A.A., Kavallieratos N.G., Rezwani A., Manzari S., & Tomanovic´ Z., 2005. Parasitoid complex (Hymenoptera, Braconidae, Aphidiinae) of Aphis craccivora Koch (Hemiptera: Aphidoidea) in Iran. Journal of Pest Science, 78, 193-198.
Rakhshani E., Talebi A.A., Manzari S., Rezwani A. & Rakhshani H., 2006. An investigation on alfalfa aphids and their parasitoids in different parts of Iran, with a key to the parasitoids (Hemiptera: Aphididae; Hymenoptera: Braconidae: Aphidiinae). Journal of Entomological Society of Iran, 25(2),1-14.
Rakhshani E., Talebi A.A., Manzari S., Tomanovic Ž., Starý P. & Rezwani A., 2007. Preliminary taxonomic study of the genus Praon (Hymenoptera: Braconidae: Aphidiinae) and its host associations in Iran. Journal of Entomological Society of Iran, 26(2), 19-34.
Rakhshani E., Talebi A.A., Starý P., Tomanovic E., Kavallieratos N.G. & Manzari S., 2008. A review of Aphidius Nees (Hymenoptera: Braconidae: Aphidiinae) in Iran: host associations, distribution and taxonomic not. Zootaxa, 1767, 37-54. https://doi.org/10.11646/zootaxa.1767.1.2
Remaudière G. & Autrique A., 1984. Contribution à l’écologie des aphides africains. Food Alimentary Organisation, Paris, 64 p.
Remaudière G. & Remaudière M., 1997. Catalogue des Aphididae du Monde. INRA : Paris, 473p.
Remaudière G., Autrique A., Eastop V.F., Stary P., & Aymonin, G., 1985. Contribution à l’écologie des aphides africains. Organisation des Nations Unies pour l’alimentation et l’agriculture : Rome, 214p.
San Martin G., 2004. Clé de détermination des Chrysopidae de Belgique. Jeunes & Nature: Wavre, 42p.
Senior L.J. & Mcewen P.K., 2001.The use of lacewings in biological control. In: McEwen P.K., New T.R. & Whittington A.E., eds. Lacewings in the Crop Environment. Cambridge University Press: Cambridge, 296-302.
Speight M.C.D., Withers, P. & Dussaix, C., 2015. CléStN la détermination de Syrphidae Européens (Diptères). Syrphe the Net, the database of European Syrphidae. Vol 81, 39p.
Stary P., 1970. Biology of aphid parasites (Hymenoptera: Aphidiidae) with respect to integrared control. Vol. 6. Edition The Hague: Netherlands, 643p.
Stary P., 1979. Aphid parasitoid (Hymenoptera: Aphidiidae) of the central Asian Area. Edition The Hague Boston, London, 114p.
Stoetzel M.B., 1985. Eucarazzia elegans (Ferrari), an aphid new to the Western hemisphere, with archival data (Homoptera: Aphididae). Proceedings of the Entomological Societyof Washington, 87, 44-48.
Stroyan H.L.G., 1961. La détermination des aphides vivant sur Citrus. Bulletin phytosanitaire, Food and Agricultural Organisation, 9(4), 45-68.
Stubbs A.E. & Falk S.J. 1983. British hoverflies. An illustrated identification guide. London British entomological & natural history society. 246p.
Talebi A.A., Rakhshani E., Fathipour Y., Starý P., Tomanovic Z. & Rajabi-Mazhar N., 2009.Aphids and their Parasitoids (Hym., Braconidae: Aphidiinae). Associated with Medicinal Plants in Iran. American-Eurasian Journal of Sustainable Agriculture,3(2), 205-219.
Torres-Quintero M. C., Arenas-Sosa I., & Peña-Chora G., 2013. Hernández-Velázquez, V.M. Feeding chamber for Myzus persicae culture (Hemiptera: Aphididae). Florida Entomologist, 96 : 1600–1602.
Verlinden L., 1994. Faune de Belgique. Syrphidés (Syrphidae). Institut Royal des Sciences Naturelles de Belgique : Bruxelles, 289p.
Völkl, W., Mackauer, M., Pell, J. K., & Brodeur, J., 2007. Predators, parasitoids and pathogens. In: Van Emden H. F. & Harrington R., eds. Aphids as crop pests. Oxford: Oxford University Press, 187-233.
Wieczorek K. & Chlond D., 2019. Description of the previously unknown sexual morphs of Eucarazzia elegans from Iran and Pakistan and the northernmost record of viviparous generation from Europe. Bulletin of Insectology,72(2), 177-186.
Wieczorek K., Kanturski M., & Junkiert L., 2013. The sexuales of giant black bark aphid, Pterochloroides persicae (Hemiptera, Aphidoidea: Lachninae). Zootaxa, 3626, 94-
98. http://dx.doi.org/10.11646/zootaxa.3626.1.4
Yattara A.A.A., Coulibaly A.K., & Francis F. 2013. Diversité et abondance des pucerons (Homoptera : Aphididae) et leur impact sur la dissémination des virus infectant la pomme de terre au Mali. Phytoprotection, 94(1), 1-7.
Zarkani A., Turanli F., Sӧnmez Ḉ., Bayram E., & Özdemir O., 2017. Incidence and economic impact of the mint aphid, Eucarazzia elegans (Ferrari) (Hemiptera, Aphididae) on some common sage. Turkish Journal of Entomology, 41(4), 383-392. http://dx.doi.org/10.16970/entoted.338082
(64 Réf.)