- Accueil
- volume 10 (2006)
- numéro 2
- Purification et caractérisation de deux phosphatases acides du tubercule de taro (Xanthosoma sp.) et leur rôle dans la conservation post-récolte
Visualisation(s): 9929 (67 ULiège)
Téléchargement(s): 294 (2 ULiège)
Purification et caractérisation de deux phosphatases acides du tubercule de taro (Xanthosoma sp.) et leur rôle dans la conservation post-récolte

Notes de la rédaction
Reçu le 1er septembre 2004, accepté le 10 avril 2006
Résumé
Deux formes de phosphatases acides (EC 3.1.3.2) ont été purifiées à partir d’extrait enzymatique brut du tubercule de taro Xanthosoma sp. variété « atoumbou oronô » ; une variété de taro très cultivée et consommée dans les régions Sud et Sud-est de la Côte d’Ivoire. Ces deux phosphatases (PI et PII) de pH optimums respectifs de 5,4 et 5,8 montrent chacune en électrophorèse sur gel de polyacrylamide en conditions natives, une seule bande protéique après purification. En électrophorèse sur gel de polyacrylamide en présence de SDS (SDS-PAGE), PI et PII montrent chacune une bande respectivement de poids moléculaires de 25000 et 22000 Da. En filtration sur gel, les deux phosphatases acides PI et PII ont des poids moléculaires estimés respectivement à 30000 et 25000 Da. Ces deux phosphatases acides sont inhibées par les ions Hg2+ et Mo7+ et les produits chimiques comme le DTNB (Dithionitrobenzoate), le pCMB (acide para-Chloromercuribenzoïque) et l’EDTA (Ethylènediaminetétraacétate). Elles sont par contre activées par les ions Mg2+ et Ca2+. Les constantes de Michaelis (KM) sont de 0,72 et 0,30 mM respectivement pour PI et PII avec le substrat pNPP (para-Nitrophényl phosphate). Ces deux phosphatases hydrolysent également à des degrés divers d’autres substrats naturels phosphorylés tels que le glucose-1-phosphate, le galactose-1-phosphate, le glucose-6-phosphate et le NADP. PI hydrolyse l’ATP alors que PII ne l’hydrolyse pas. Les deux phosphatases acides hydrolysent le pyrophosphate, mais PI l’hydrolyse mieux [KM= 0,61 mM et efficacité catalytique (Vmax/KM = 213)], ce qui suggère que le pyrophosphate serait l’un des substrats physiologiques de cette phosphatase acide au cours des phénomènes métaboliques intervenant lors de la conservation post-récolte du tubercule de taro.
Abstract
Purification and caracterization of two acid phosphatases from cocoyam tuber (Xanthosoma sp.) and its role on post-harvesting preservation. Two forms of acid phosphatases (EC 3.1.3.2) were purified from enzymatic crude extract of cocoyam tuber Xanthosoma sp., «atoumbou oronô» variety. This variety of cocoyam is cultivated and eaten in south and south-East areas of Côte d’Ivoire. These two phosphatases (PI and PII) exhibiting maximum activities at pH respectively 5.4 and 5.8 were purified to homogeneous by polyacrylamide gel electrophoresis in native conditions. In SDS-PAGE, PI and PII showed each other one band with molecular weights of 25,000 and 22,000 respectively. In gel filtration, the molecular weights of the two acid phosphatases PI and PII were estimated to 30,000 and 25,000 respectively. These two acid phosphatases were inhibited by Hg2+ and Mo7+ ions and chemicals as DTNB (Dithionitrobenzoic acid), pCMB (4-Chloromercuribenzoic acid) and EDTA (Ethylenediaminetetraacetic acid). However they were activated by Mg2+ and Ca2+. The KM values were 0.72 and 0.30 mM respectively for PI and PII with pNPP (4-Nitrophenyl phosphate). These two acid phosphatases are also able to hydrolyze at different proportions other natural phosphorylated substrates like glucose-1-phosphate, galactose-1-phosphate, glucose-6-phosphate and NADP. PI hydrolyzed ATP but not PII. The two acid phosphatases hydrolyzed pyrophosphate. However, PI [KM = 0.61 mM and catalytic efficiency (Vmax/KM = 213)] made it better than PII, it suggests that pyrophosphate should be one of the physiological substrates of this acid phosphatase involved in the metabolic process during the post-harvesting preservation of cocoyam tuber.
Table des matières
1. Introduction
1Les phosphatases acides (EC 3.1.3.2) forment un groupe d’enzymes qui catalysent l’hydrolyse de liaisons d’esters phosphoriques dans un environnement acide autour de pH 6,0 (Vincent et al., 1992). Elles sont rencontrées aussi bien dans le règne animal que dans le règne végétal et microbien (Hollander, 1970). Chez les végétaux, les phosphatases acides ont été purifiées et caractérisées au niveau des tubercules (Kamenan, 1984 ; Gellatly et al., 1994 ; Kusudo et al., 2003), des graines (Ullah, Gibson, 1988 ; Olczak et al., 1997 ; Granjeiro et al., 1999), des racines (Panara et al., 1990), des feuilles (Staswick et al., 1994) et des bulbes (Guo, Pesacreta, 1997). Elles semblent jouer des rôles très importants dans l’hydrolyse des monoesters phosphoriques et le transfert des groupements phosphate (Bieleski, 1973 ; Kamenan, 1984). Chez les tubercules, il existe deux voies enzymatiques de dégradation de l’amidon au cours de la conservation post-récolte : la voie amylasique et la voie phosphorylasique (Arreguin-Lozano, Bonner, 1949 ; Schwimmer, 1953). Depuis de nombreuses années, Nakamura et al. (1951) ont montré que la phosphatase acide intervient au cours de la dégradation de l’amidon des tubercules d’igname par la voie phosphorylasique. Diopoh et Kamenan (1981) ont indiqué que les phosphatases acides assurent l’apport de groupements phosphate au cours de la dégradation de l’amidon du tubercule de Dioscorea cayenesis rotundata par voie phosphorylasique. Très récemment, Kouadio (2004) a montré qu’au cours de la conservation post-récolte du tubercule de taro Xanthosoma sp. variété « atoumbou oronô », l’évolution de l’activité phosphatasique acide laisse présager que cette enzyme jouerait un rôle important au cours de la dégradation de l’amidon. Par ailleurs, le problème de conservation des tubercules de ce taro constitue un facteur limitant à sa culture intensive. Chaque année, les pertes post-récoltes subies par les producteurs de taro sont estimées à 30 % de la production totale (Amani, 1994), ce qui représente une énorme perte sur le plan économique.
2Dans la présente étude, nous avons purifié deux phosphatases acides du tubercule de taro Xanthosoma sp. variété « atoumbou oronô », puis étudié leurs propriétés physico-chimiques, cinétiques et moléculaires en vue de mieux cerner le rôle que chacune d’elles pourraient jouer au cours du métabolisme post-récolte de ce tubercule.
2. Matériel et méthodes
2.1. Matériel
3Les tubercules de taro Xanthosoma sp. variété « atoumbou oronô » sont issus de la région de «Agneby» (à 65 km au nord d’Abidjan). Ces tubercules ont une masse comprise entre 0,2 et 1,0 kg.
4Le pNPP (para-Nitrophényl phosphate), le pyrophosphate et les gels de chromatographie (sephacryl s-200 HR et DEAE-sepharose CL-6B) proviennent de sigma-Aldrich et le gel phényl-sepharose 6B de pharmacia lkb biotech. Tous les autres produits chimiques sont de qualité analytique.
2.2. Préparation de l’extrait brut enzymatique
5Plusieurs tubercules de taro sont épluchés, puis découpés en petites tranches à l’aide d’un couteau inoxydable. Ensuite, 100 g de ces tranches lavées à l’eau distillée sont broyées à l’aide d’un broyeur WARING dans 200 ml de tampon acétate 20 mM pH 5,6 contenant 1 g de bisulfite de sodium. Le broyat obtenu est centrifugé à 5000 tours par min à 4 °C pendant 30 min à l’aide d’une centrifugeuse réfrigérée ALRESA. Le surnageant obtenu est à nouveau centrifugé dans les mêmes conditions. Le dernier surnageant obtenu, constitue l’extrait enzymatique brut.
2.3. Techniques de dosage
6Au cours des différentes étapes de purification, l’activité phosphatasique acide a été dosée en utilisant un milieu réactionnel composé de 125 µl de tampon acétate 20 mM pH 5,6 ; 75 µl de pNPP 5 mM préparé dans le même tampon et 50 µl de solution enzymatique. Ce milieu est incubé au bain-marie pendant 10 min à 37 °C et agité. La réaction est arrêtée par addition de 4 ml de solution de carbonate de sodium 2 % (p/v). La quantité de para-nitrophénol (pNP) libéré est mesurée au spectrophotomètre UV-visible (GENESIS 5) à 410 nm contre un blanc contenant tous les réactifs à l’exception de la solution enzymatique. Les densités optiques sont converties en µ mole de pNP grâce à une courbe d’étalonnage obtenue avec une solution de pNP 0,2 mM. L’activité spécifique obtenue est exprimée en µ mole de pNP libéré par min et par mg de protéine.
7Lors de l’étude de la spécificité de substrat, l’activité phosphatasique a été dosée en utilisant un milieu identique avec différents substrats préparés à la concentration de 5 mM. Après 10 min d’incubation, la quantité de phosphate inorganique libéré est mesurée par la méthode de Taussky et Shorr (1953).
8Les quantités de protéines dans les différentes fractions lors de la purification, ainsi que lors de la détermination de l’activité spécifique, ont été estimées par la méthode de Lowry et al. (1951).
2.4. Purification des phosphatases
9Pour palier le problème de la périodicité d’approvisionnement du taro Xanthosoma sp. variété « atoumbou oronô », un litre d’extrait enzymatique brut a été lyophilisé pendant deux jours à l’aide d’un lyophilisateur TELESTAR. L’extrait lyophilisé (environ 4 g) obtenu est hermétiquement conservé à 4 °C.
10La purification proprement dite a été menée en trois étapes : 1 g d’extrait enzymatique lyophilisé est dissous dans 15 ml de tampon acétate 20 mM pH 5,6, puis déposé sur le gel DEAE-sepharose CL-6B (2,4 6 cm) préalablement équilibré avec le même le tampon. Le débit de la chromatographie est fixé et maintenu constant à 0,28 ml.min-1 grâce à une pompe péristaltique et des fractions de 1 ml sont collectées. Le gel est lavé par deux équivalents volume de colonne avec le même tampon pour éliminer les particules non fixées. Les particules fixées sont éluées par l’application d’un gradient linéaire croissant de NaCl (0 à 1 M) à pH 5,6. Les fractions contenant l’activité phosphatasique sont rassemblées et les protéines sont précipitées par saturation au sulfate d’ammonium à 80 % (p/v).
11Le culot protéique obtenu après centrifugation à 5000 tours/min pendant 30 min est dissous dans 1 ml de tampon acétate 20 mM pH 5,6 et soumis à une chromatographie d’exclusion-diffusion sur une colonne de gel sephacryl S-200 HR (1,6 x 62 cm) équilibrée avec du tampon acétate 20 mM pH 5,6. Le débit est fixé et maintenu à 0,22 ml.min-1 et des fractions de 1 ml sont collectées. Les fractions les plus actives de cette chromatographie sont rassemblées, saturées avec du sulfate d’ammonium 1,7 M et déposées sur une colonne d’interaction hydrophobe de phénylsepharose CL-6B (1,6 x 6 cm) préalablement équilibrée avec du tampon acétate 20 mM contenant du sulfate d’ammonium 1,7 M. Les protéines non retenues par le gel sont éluées avec le tampon acétate 20 mM pH 5,6 contenant du sulfate d’ammonium 1,7 M. Les protéines fixées sont décrochées par l’application d’un gradient linéaire décroissant (1,7 à 0 M). Le débit de l’élution est de 0,22 ml.min-1. Des fractions de 1 ml sont collectées et les plus actives sont rassemblées, puis dialysées contre le tampon acétate 20 mM pH 5,6.
2.5. Détermination des propriétés physico-chimiques, cinétiques et moléculaires
12La détermination du pH optimum d’hydrolyse a été réalisée dans une gamme de pH comprise entre 3,6 et 6,2 en utilisant les tampons acétate (pH 3,6 à 5,4) et citrate de sodium (pH 5,4 à 6,2) 20 mM. Quant à la stabilité au pH, elle a été vérifiée entre les pH 2,2 et 8,00 dans les tampons HCl-glycine 20 mM (pH 2,2 à 3,0), acétate 20 mM (pH 3,6 à 5,4) et Tris-HCl 20 mM (pH 7,2 à 8,0). Les solutions enzymatiques sont préincubées à 37 °C pendant 1 h dans les tampons aux différents pH indiqués. Ensuite, une aliquote de 50 µl de chaque solution enzymatique est prélevée et mise dans un milieu réactionnel contenant préalablement 125 µl de tampon acétate pH 5,6 et 75 µl de substrat pNPP 5 mM. Les activités résiduelles sont dosées au spectrophotomètre UV-visible (GENESIS 5) à 410 nm contre un blanc contenant tous les réactifs à l’exception de la solution enzymatique et exprimées en pourcentage par rapport à l’activité maximale.
13La température optimale d’hydrolyse est déterminée en mesurant l’activité dans le tampon acétate 20 mM pH 5,6 en présence de pNPP 5 mM, pendant 10 min à des températures comprises entre 30 et 80 °C. L’inactivation thermique est étudiée en préincubant chaque solution enzymatique à 37 °C et à sa température optimale d’hydrolyse pendant 2 h. Une aliquote de 50 µl de chaque solution enzymatique est prélevée toutes les 10 min et l’activité est dosée au spectrophotomètre UV-visible (GENESIS 5) à 410 nm contre un blanc contenant tous les réactifs à l’exception de la solution enzymatique. Cette activité est ensuite exprimée en pourcentage par rapport à l’activité initiale. La dénaturation thermique a été réalisée en préincubant la solution enzymatique pendant 10 min aux températures comprises entre 30 et 75 °C. Au terme de cette préincubation, la solution enzymatique est refroidie à la température ambiante. Ensuite, pour chaque température de préincubation, une aliquote de 50 µl de chaque solution enzymatique est prélevée et l’activité est dosée au spectrophotomètre UV-visible (GENESIS 5) à 410 nm contre un blanc contenant tous les réactifs à l’exception de la solution enzymatique. Cette activité est exprimée en pourcentage par rapport à l’activité maximale.
14L’étude de la spécificité de substrat a été réalisée en testant l’activité phosphatasique sur différents substrats phosphorylés, tous à la concentration de 5 mM. Les essais sont réalisés à 37 °C dans un milieu réactionnel contenant 125 µl de tampon acétate 20 mM pH 5,6 ; 50 µl de solution enzymatique et 75 µl de substrat. Le pourcentage d’hydrolyse de chaque substrat est ensuite déterminé en prenant l’activité obtenue avec le pNPP pour 100 %.
15L’influence des composés chimiques a été réalisée aux concentrations de 0,5 et 5 M. Le milieu réactionnel est constitué de 125 µl de solution de composé chimique préparé dans le tampon acétate 20 mM pH 5,6 et 50 µl de solution enzymatique. Après une préincubation de 10 min à 37 °C, 75 µl de solution de pNPP 5 mM y sont ajoutés et après 10 min d’incubation à la même température, l’activité enzymatique est dosée au spectrophotomètre UV-visible (GENESIS 5) à 410 nm contre un blanc contenant tous les réactifs à l’exception de la solution enzymatique. Cette activité est ensuite exprimée en pourcentage de l’activité en absence de composé chimique.
16Les paramètres cinétiques (KM et Vmax) ont été déterminés selon Lineweaver et Burk (1934) en utilisant des concentrations de substrat comprises entre 0,1 et 5 mM.
17Les poids moléculaires des phosphatases ont été déterminés par électrophorèse sur gel de polyacrylamide en présence de SDS et de ß-mercaptoéthanol. Les enzymes, dans un tampon tris-HCl 125 mM pH 6,8 contenant du SDS 4 % (p/v), du ß-mercaptoéthanol 1 % (v/v), du glycérol 20 % (v/v) et du bleu de bromophénol 0,025 % (p/v) sont chauffés au bain-marie bouillant pendant 5 min. L’électrophorèse sur gel de polyacryamide en présence de SDS est réalisée selon Laemmli (1970) sur des plaques de silices (7 8 cm) et de 1,5 mm d’épaisseur de gel. Le gel d’acrylamide (12 %, p/v) est préparé dans le tampon tris-Hcl 375 mM pH 8,8 contenant du SDS 0,1 % (p/v). Des marqueurs de faible poids moléculaire de bio-rad sont utilisés comme protéines de références. Les protéines sont colorées au bleu de coomassie brillant R-250 0,25 % (p/v). L’électrophorèse en conditions natives a été réalisée en utilisant la même méthode, mais sans utilisation de SDS et de ß-mercaptoéthanol dans les différents tampons et milieux de préparation.
18Les poids moléculaires des phosphatases natives ont été estimés par filtration sur gel en chromatographie liquide haute performance (HPLC) utilisant une colonne TSK (QC-PAK GFC 200) (0,78 x 15 cm). Les protéines de référence utilisées pour l’étalonnage sont la ß-amylase (200 000 Da), le sérum albumine bovine (66000 Da), l’ovalbumine (45000 Da) et le cytochrome C (12400 Da).
3. Résultats
3.1. Purification des phosphatases
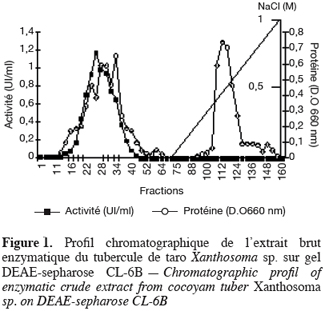
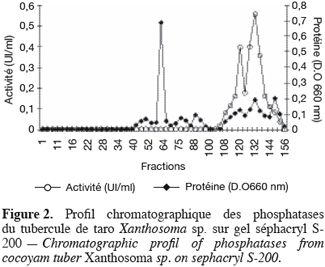
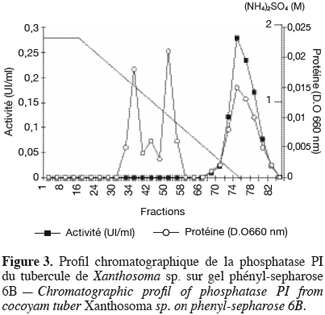
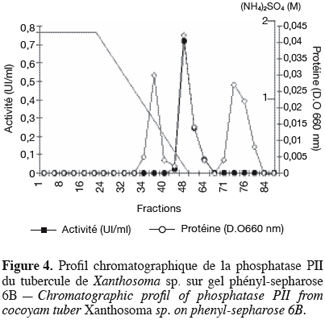
19Les phosphatases acides du tubercule de taro Xanthosoma sp. variété « atoumbou oronô » ont été purifiées par un protocole comprenant trois grandes étapes. La chromatographie échangeuse d’anions sur DEAE-sepharose a permis d’obtenir deux principaux pics de protéines ; l’un obtenu avec l’application du gradient linéaire croissant de NaCl et l’autre contenant l’activité phosphatasique, élué directement après l’application de l’échantillon sur la colonne (Figure 1). Cette étape a permis d’éliminer la majorité des protéines contenues dans l’extrait brut enzymatique. La chromatographie d’exclusion-diffusion sur sephacryl S-200 a permis d’obtenir deux pics phosphatasiques (PI et PII) élués respectivement aux alentours des fractions 128 et 140, traduisant ainsi la présence de deux formes de phosphatases (Figure 2). La dernière étape, impliquant une chromatographie d’interaction hydrophobe sur phénylsepharose a donné pour chacune des phosphatases issues de l’étape précédente trois pics protéiques majeurs bien distincts, dont un seul contient l’activité phosphatasique (Figures 3 et 4). Au terme de ces étapes chromatographiques, on note que les phosphatases PI et PII du tubercule de taro Xanthosoma sp. ont été purifiées respectivement 45 et 50 fois à partir de 1 g d’extrait brut enzymatique lyophilisé et des quantités d’environ 40 et 120 µg ont respectivement été obtenues (Tableau 1). Chacune des deux phosphatases a montré en électrophorèse sur gel de polyacrylamide, en conditions natives (non montré ici), comme en conditions dénaturantes (Figure 5), une seule bande protéique.
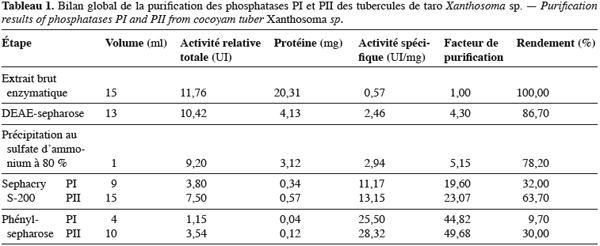

3.2. Propriétés moléculaires, physico-chimiques et cinétiques des phosphatases
20Les poids moléculaires relatifs des phosphatases natives déterminés par filtration sur gel sont de 30000 Da pour PI et 25 000 Da pour PII. En électrophorèse sur gel de polyacrylamide en présence de SDS, les bandes uniques présentées par les deux phosphatases correspondent respectivement à des poids moléculaires de 25000 Da pour PI et 22000 Da pour PII (Figure 5).
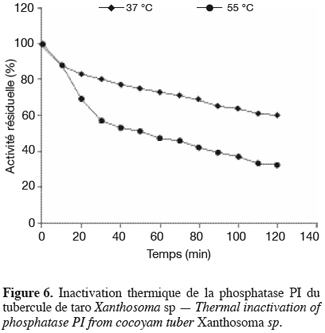
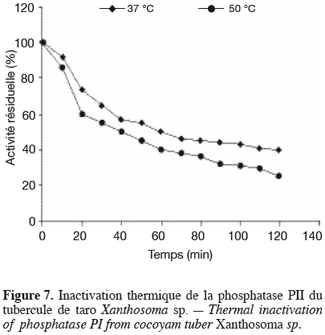
21L’étude de l’influence du pH a montré que les phosphatases PI et PII ont respectivement des pH optimums d’hydrolyse de 5,4 et 5,8 et des zones de stabilité au pH identiques, comprises entre 4,0 et 6,2. Quant à l’étude de l’influence de la température, elle a montré que la température optimale d’hydrolyse est de 55 °C pour la phosphatase PI et de 50 °C pour la phosphatase PII. Préincubées à 37 °C pendant 120 min dans le tampon acétate 20 mM pH 5,6, la phosphatase PI perd 40 % de son activité et la phosphatase PII, 60 % (Figures 6 et 7). Préincubées dans les mêmes conditions que précédemment, mais à leurs températures optimales d’activité, la phosphatase PI perd 68 % de son activité et la phosphatase PII en perd 75 % (Figures 6 et 7). à 75 °C, les deux enzymes sont totalement dénaturées après 10 min de préincubation.
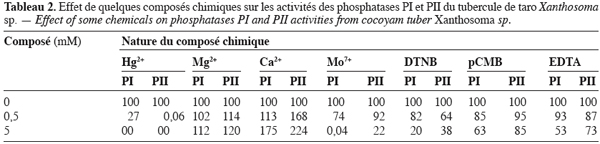
22L’influence de divers composés chimiques a donné les résultats indiqués dans le tableau 2. Il ressort de l’observation de ce tableau que les ions Hg2+ et Mo7+ exercent un effet inhibiteur sur les activités des deux enzymes alors que les ions Mg2+ et Ca2+ ont un important effet activateur sur leurs activités. Cependant, il est à noter que l’importance de ces effets varie d’une enzyme à une autre. Quant aux autres effecteurs (DTNB, pCMB et EDTA), ils exercent tous un effet inhibiteur sur l’activité des deux phosphatases.
23L’étude de la spécificité de substrat a donné les résultats consignés dans le tableau 3. On note que le pyrophosphate et l’uridine-5’-phosphate glucose sont les substrats les mieux hydrolysés par les deux phosphatases.

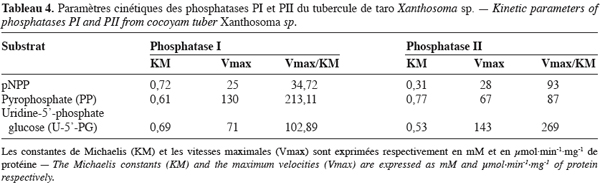
24Les paramètres cinétiques (KM, Vmax et Vmax/KM) déterminés pour ces deux enzymes sont consignés dans le tableau 4. Ce tableau indique que la phosphatase PI présente la plus grande affinité et le meilleur pouvoir catalytique à l’égard du pyrophosphate alors que pour la phosphatase PII cela concerne le pNPP et l’uridine-5’- phosphate glucose.
4. Discussion
25L’utilisation de trois étapes chromatographiques nous a permis de purifier deux phosphatases acides du tubercule de taro Xanthosoma sp. variété « atoumbou oronô ». Les rendements obtenus à la fin de cette purification (PI : 9,70 % ; PII : 30,0 %) sont nettement meilleurs que ceux obtenus par certains auteurs pour des phosphatases acides d’origines végétales (Kamenan, 1984 ; Panara et al. 1990). Ces auteurs ont obtenus respectivement des rendements de 6,0 %, 6,8 % et 5,9 % après la purification de trois phosphatases acides de Dioscorea cayenesis rotundata et un rendement de 3 % après la purification d’une phosphatase acide de racine d’orge. Le rendement obtenu avec la phosphatase PII est très proche de celui obtenu après la purification d’une phosphatase acide dans les cotylédons en germination de soja (28,2 %) (Ullah, Gibson, 1988). De même, la phosphatase PI a un rendement de purification identique à celui de la phosphatase acide de la graine de Lipinus luteus (Olczak et al., 1997). Les phosphatases PI (25000 ± 5000 Da) et PII (22000 ± 3000 Da) du tubercule de taro Xanthosoma sp. « atoumbou oronô » semblent être des protéines de faible poids moléculaire par rapport aux autres phosphatases acides répertoriées dans le règne végétal : 53 000 Da (Ullah, Gibson, 1988) ; 48000 Da (Panara et al., 1990) ; 94000 Da (Olczak et al., 1997) ; 100000 Da (Roknabadi et al., 1999) ; 39000 Da (Shekar et al., 2002) ; 55000 Da (Shih et al., 1997 ) ; 58000 Da (Yenigum, Guvenillir, 2003). Par ailleurs, on note que les deux phosphatases acides PI et PII sont monomériques comme la plupart des phosphatases acides du monde végétal. Les valeurs optimales de pH des phosphatases PI et PII se situent dans la marge générale des valeurs de pH optimum des phosphatases acides comprises entre 4,5 et 6,0 (Kamenan, 1984 ; Panara et al., 1990 ; Olczak et al., 1997 ; Roknabadi et al., 1999 ; Shih et al., 1997 ; Yenigum, Guvenillir, 2003). Les zones de stabilité de pH identiques pour les deux phosphatases et comprises entre 4,0 et 6,2, sont cependant moins larges que celle de la phosphatase acide de jeune plant d’ail comprise entre pH 4,0 et 10,0 (Yenigum, Guvenillir, 2003). Les résultats concernant l’influence de la température indiquent que les phosphatases PI et PII sont des enzymes mésophiles comme la plupart des phosphatases acides citées dans la littérature. Il est important de souligner que les quelques légères différences de comportement vis-à-vis du pH et de la température observées entre les phosphatases I et II permettent de les différencier l’une de l’autre. L’étude de l’influence des ions métalliques a révélé un important effet activateur de l’ion Mg2+. Cet ion pourrait être un cofacteur essentiel pour les deux phosphatases. En effet, Shih et al. (1997) ont purifié une phosphatase acide de comportement identique dans les feuilles d’épinard pour laquelle l’ion Mg2+ est un cofacteur. Quant à l’influence du DTNB et du pCMB, l’effet inhibiteur de chacun de ces composés chimiques indique que les deux phosphatases acides contiendraient des groupements thiols essentiels à la catalyse. L’EDTA, qui est un chélateur d’ions métalliques, exerce un effet inhibiteur, ceci pourrait indiquer que certains ions seraient indispensables à l’activité des deux phosphatases. Par ailleurs, on note que les deux phosphatases hydrolysent plus ou moins d’autres substrats phosphorylés. Mais, la remarque fondamentale est que la phosphatase PII hydrolyse l’ATP alors que la phosphatase PI ne l’hydrolyse pas. Ce comportement enzymatique peut servir de critère de différenciation entre les deux phosphatases du tubercule de taro Xanthosoma sp. variété « atoumbou oronô ». En outre, la phosphatase PII hydrolyse mieux les sucres phosphorylés que la phosphatase PI. Tous ces comportements que nous venons de mentionner ont sûrement une signification physiologique. La phosphatase PII pourrait intervenir dans l’apport d’énergie et dans la phosphorylation et déphosphorylation des sucres au cours du métabolisme post-récolte du tubercule. Diopoh, Kamenan (1981) et Hamdan (1987) ont noté la même situation chez le tubercule d’igname Dioscorea cayenesis rotundata. Quand à la phosphatase PI, elle hydrolyse nettement mieux le pyrophosphate que la phosphatase PII. Ainsi, la phosphatase PI pourrait être une pyrophosphatase comme la phosphatase acide purifiée à partir de feuilles d’épinard (Spinacia oleracea) (Shih et al., 1997). Le pyrophosphate pourrait être un substrat physiologique potentiel de la phosphatase PI au cours de la conservation du tubercule de taro Xanthosoma sp. « atoumbou oronô ». Une phosphatase acide ayant le même comportement a été mise en évidence dans la graine de soja au cours de sa germination (Dos Prazeres et al., 2004). Cette hydrolyse significative du pyrophosphate par la phosphatase I, fournirait des groupements phosphates qui interviendraient dans la dégradation par la voie phosphorylasique de l’amidon du tubercule de taro Xanthosoma sp. « atoumbou oronô » au cours de sa conservation post-récolte comme l’a suggéré Kouadio (2004).
5. Conclusion
26Le tubercule du taro Xanthosoma sp. variété « atoumbou oronô » contient deux phosphatases acides. Ces deux phosphatases qui sont vraissemblablement des phosphatases cytoplasmiques à cause de leur méthode d’extraction ont certaines propriétés physico-chimiques très proches, notamment les pH et températures optimales d’hydrolyse. Cependant leurs propriétés moléculaires, cinétiques et physico-chimiques comme le poids moléculaire, la spécificité de substrat et l’influence de quelques composés chimiques ont permis de les différencier l’une de l’autre. Par ailleurs, l’étude de la spécificité de substrat de ces deux phosphatases a montré que celles-ci pourraient jouer un rôle important dans le métabolisme post-récolte du tubercule en tant que fournisseurs d’énergie et surtout fournisseurs et transporteurs de groupements phosphate au cours de la dégradation de l’amidon par la voie phosphorylasique. Ce résultat est très important car il pourrait être très utile dans la recherche de solution à l’épineux problème de conservation des tubercules du taro Xanthosoma sp. variété « atoumbou oronô ». En effet, s’il devait être possible de parvenir à baisser les activités de ces phosphatases dans le tubercule en isolant et modifiant les gènes codant pour ces deux protéines enzymatiques, cela pourrait diminuer la vitesse de dégradation de l’amidon par la voie phosphorylasique et prolonger ainsi la durée de conservation du tubercule.
Bibliographie
Amani NG. (1994). Contribution à l’étude des tubercules de taro (Xanthosoma sagittifolium (L. Schott) : évolution des propriétés physico-chimiques de l’amidon au cours du traitement technologique. Thèse 3e cycle, Univ. Nationale de Côte d’Ivoire, 117 p.
Arreguin-Lozano B., Bonner J. (1949). Experiments on sucrose formation by potato tubers as influenced by temperature. Plant Physiol. 24, p. 720–738.
Bieleski RL. (1973). Phosphate pools, phosphate transport and phosphate availability. Annu. Rev. Plant Physiol. 24, p. 225–252.
Diopoh J., Kamenan A. (1981). Distribution de l’amylase, de la phosphorylase et de la phosphatase acide dans quelques dioscoréacées de Côte d’Ivoire. Physiol. Vég. 19, p. 401–405.
Dos Prazeres JN., Ferreira CV., Aoyama H. (2004). Acid phosphatase activities during the germination of Glycine max seeds. Plant Physiol. Biochem. 42, p. 15–20.
Gellatly KS., Moorhead GBG., Duff SMG., Lefebvre DD., Plaxton WC. (1994). Purification and characterization of a potato tuber acid phosphatase having significant phosphotyrosine phosphatase activity. Plant Physiol. 106, p. 223–232.
Granjeiro PA., Ferreira CV., Granjeiro JM., Taga EM., Aoyama H. (1999). Purification and kinetic properties of a castor bean seed acid phosphatase containing sulffhyldryl groups. Physiol. Platarium 107, p. 151–158.
Guo J., Pesacreta JC. (1997). Purification and characterization of an acid phosphatase from the bulb of Allium cepa L. J. Plant Physiol. 151, p. 520–527.
Hamdan RI. (1987). Purification et propriétés physico-chimiques de l’amidon phosphorylase d’igname (Dioscorea cayenesis). Thèse de doctorat 3e cycle. Univ. Nationale de Côte d’Ivoire, 89 p.
Hollander VP. (1970). Acid phosphatase. In Boyer PD. (ed.). The enzymes. Vol. 4. New York: Academie Press, p. 449–498.
Kamenan A. (1984). Purification et études physico-chimiques de trois phosphatases acides de Dioscorea cayenesis rotundata. Thèse d’état des Sciences Physiques, Univ. nationale de Côte d’Ivoire, 134 p.
Kouadio NEJP. (2004). Contribution à l’étude du tubercule de taro Xanthosoma sp. variété « atoumbou oronô » : études de l’évolution de quelques paramètres biochimiques au cours de sa conservation post-récolte, purification et caractérisation de deux phosphatases acides. Thèse 3e cycle. Univ. Abobo-Adjamé, Côte d’Ivoire, 103 p.
Kusudo T., Sakaki T., Inouye K. (2003). Purification and characterization of purple acid phosphatase PAP1 from dry powder of sweet potato. Biosci. Biotechnol. Biochem. 67, p. 1609–1611.
Laemmli UK. (1970). Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227, p. 658–685.
Lineweaver H., Burk D. (1934). The determination of enzyme dissociation constants. J. Am. Chem. Soc. 56, p. 658–666.
Lowry OH., Rosebrough NJ., Farr AL., Randall RJ. (1951). Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193, p. 265–275.
Nakamura M., Yamazoki I., Marbo B. (1951). Phosphorylase, phosphatase and ß-amylase from Dioscorea tubers. J. Agric. Chem. Soc. Japan 24, p. 197–201.
Olczak M., Watorek W., Morawiecka B. (1997). Purification and characterization of acid phosphatase from yellow lupin (L. luteus) seeds. Biochim. Biophys. Acta. 1341, p. 14–21.
Panara F., Pasqualini S., Antonielli M. (1990). Multiple forms of barley root acid phosphatases. Purification and some characteristics of the major cytoplasmic isoenzyme. Biochim. Biophys. Acta. 1037, p. 73–80.
Roknabadi SM., Bose SK., Taneja V. (1999). A histidine thiol 100 kDa, tetrameric acid phosphatase from lentil, Lens esculenta, seeds with the characteristics of protein tyrosine phosphatase. Biochim. Biophys. Acta. 1433, p. 272–280.
Schwimmer S. (1953). Enzyme systems of white potato. J. Agr. Food Chem. 1, p. 1063–1069.
Shekar S., Tumaney AW., Rao TJ., Rajaekharan R. (2002). Isolation of lysophosphatidic acid phosphatase from developing peanut cotyledons. Plant Physiol. 12 (8), p. 988–996.
Shih SJ., Lin LF., Su JY., Soong YK., Rong LP. (1997). Purification and characterization of Thylakoid Membrane-Bound Inorganic Pyrophosphtase from Spincia oleracia. Arch. Biochem. Biophys. 346, p. 102–112.
Staswick PE., Papa C., Huang J., Rhee Y. (1994). Purification of the major soybean leaf acid phosphatase that is increased by seed-pod removal. Plant Physiol. 104, p. 49–57.
Taussky HH., Shorr E. (1953). A microcolometric method for determination of inorganic phosphorus. J. Biol. Chem. 202, p. 675–685.
Ullah AHJ., Gibson DM. (1988). Purification and characterisation of acid phosphatase from cotyledons of germinating soybean seeds. Arch. Biochem. Biophys. 260, p. 514–520.
Vincent JB., Crowder MW., Averill BA. (1992). Hydrolysis of phosphatate monoester: a biological problem with multiple chemical solutions. Trends Biochem. Sci. 17, p. 105–110.
Yenigum B., Guvenillir Y. (2003). Partial purification and kinetic characterisation of acid phosphatase from garlic seedling. Appl. Biochem. Biotechnol. 105, p. 677–687.
Pour citer cet article
A propos de : Eugène Jean Parfait Kouadio
Laboratoire de Biochimie et Technologie des Aliments de l’Unité de Formation et de Recherche en Sciences et Technologie des Aliments de l’Université d’Abobo-Adjamé. 02 BP 801 Abidjan 02 (Côte d’Ivoire).
A propos de : Sébastien Niamké
Laboratoire de Biochimie. Unité de Recherche sur la Biocatalyse, CNRS 2230. Faculté des Sciences et des Techniques. Rue de la Houssinière, 2. BP 92208, F 44322 Nantes Cedex 3 (France). E-mail : niamkes@yahoo.fr
A propos de : Lucien Patrice Kouamé
Laboratoire de Biochimie et Technologie des Aliments de l’Unité de Formation et de Recherche en Sciences et Technologie des Aliments de l’Université d’Abobo-Adjamé. 02 BP 801 Abidjan 02 (Côte d’Ivoire).
A propos de : Soumaïla Dabonné
Laboratoire de Biochimie. Unité de Recherche sur la Biocatalyse, CNRS 2230. Faculté des Sciences et des Techniques. Rue de la Houssinière, 2. BP 92208, F 44322 Nantes Cedex 3 (France).
A propos de : Alphonse Kamenan
Laboratoire de Biochimie et Technologie des Aliments de l’Unité de Formation et de Recherche en Sciences et Technologie des Aliments de l’Université d’Abobo-Adjamé. 02 BP 801 Abidjan 02 (Côte d’Ivoire).





