Utilisation des mutations induites pour l'étude de l'embryogenèse chez le haricot Phaseolus vulgaris L. et deux plantes modèles, Arabidopsis thaliana (L.) Heynh. et Zea mays L.
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Phytotechnie tropicale et d’Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : sudeis10@hotmail.com
Centre Wallon de Recherches Agronomiques (CRA-W). Département de Biotechnologie. Chaussée de Charleroi, 234. B-5030 Gembloux (Belgique).
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Phytotechnie tropicale et d’Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : sudeis10@hotmail.com
reçu le 22 janvier 2010, accepté le 24 juin 2010
Résumé
L'amélioration du haricot commun Phaseolus vulgaris L. par hybridations interspécifiques avec les espèces Phaseolus coccineus L. et Phaseolus polyanthus Greenm. utilisées comme parents femelles se solde généralement par l'avortement des embryons hybrides. L'identification des gènes intervenant dans le développement normal des embryons permettrait d'expliquer en partie l'avortement des embryons hybrides ; les mutations induites pourraient donc être une alternative chez Phaseolus pour identifier les gènes clés de l'embryogenèse. Cette étude présente quelques exemples d'utilisation des mutations induites dans l'identification des gènes indispensables au bon déroulement de l'embryogenèse chez Arabidopsis thaliana (L.) Heyhn. et Zea mays L., plantes modèles de l'étude de l'embryogenèse chez les dicotylédones et les monocotylédones, respectivement. Chez ces deux espèces, des mutants du développement embryonnaire ont été identifiés en utilisant la mutagenèse insertionnelle et la mutagenèse chimique à l'Éthyl Méthane Sulfonate (EMS). Chez Arabidopsis, les mutants sont affectés dans la polarité apico-basale, l'organisation radiale et les étapes post-embryonnaires et certains embryons mutants sont affectés dans la signalisation de l'auxine. Chez le maïs, les mutants defective kernel (dek), altérés au niveau de l'embryon et de l'albumen, et les mutants emb pour lesquels seul l'embryon est affecté, ont été identifiés. Chez le haricot commun, des plantes déficientes dans la formation des graines ont été identifiées suite à la mutagenèse à l'EMS. Les embryons des graines de ces plantes arrêtent de croître à différents stades de développement et présentent des anomalies principalement au niveau du suspenseur et des cotylédons.
Abstract
Use of induced mutations in embryogenesis study in bean Phaseolus vulgaris L. and two model plants, Arabidopsis thaliana (L.) Heynh. and Zea mays L. Breeding of common bean, Phaseolus vulgaris L., through interspecific hybridizations with the species Phaseolus coccineus L. and Phaseolus polyanthus Greenm. as female parents leads to the abortion of immature embryos. Identification of genes required for embryo development could partly explain the abortion of hybrid embryos; induced mutations could thus be an alternative to identify key genes involved in Phaseolus embryogenesis. This paper is a review which shows a few examples of the use of induced mutations in the identification of essential genes for embryogenesis in two model plants, Arabidopsis thaliana (L.) Heyhn. for dicots and Zea mays L. for monocots. In these two species, embryo development mutants have been isolated using insertional mutagenesis and chemical mutagenesis with Ethyl Methane Sulfonate (EMS). Arabidopsis embryo mutants are affected in apical-basal axis polarity, radial pattern and in post-embryonic stages. Some Arabidopsis embryo mutants are defected in auxin signalisation. In maize, defective kernel (dek) mutants are affected in the embryo and the endosperm, while in embryo specific (emb) mutants, only the embryo is affected. In common bean, plants deficient in seed development were isolated using EMS mutagenesis. Embryos inside the seeds fail to growth at different stages of development and show abnormalities mainly in the suspensor and the cotyledons.
1. Introduction
1Dans le genre Phaseolus, le haricot commun (Phaseolus vulgaris L.) est l'espèce économiquement la plus importante avec plus de 90 % de la production mondiale de haricot. Il constitue la principale légumineuse alimentaire de plus de 300 millions de personnes en Amérique latine et en Afrique centrale et de l'Est (Broughton et al., 2003). La production mondiale en haricot sec en 2007 était estimée à 19,29 millions de tonnes. La surface totale consacrée à cette production représentait environ 26,92 millions d'hectares pour un rendement moyen de 0,72 t.ha-1. Le rendement moyen en Amérique du Nord et dans l'Union européenne était de 1,63 t.ha-1 et pour l'Afrique, il n'était que de 0,59 t.ha-1 (FAO, 2009). Ce faible rendement est dû d'une part, aux contraintes biotiques et abiotiques de production auxquelles le haricot commun est très sensible et d'autre part, à l'absence de variétés résistantes ou tolérantes à ces contraintes au sein du pool génique primaire du haricot commun. En effet, plus de 200 agents pathogènes (fongiques, bactériens et viraux) sont connus chez le haricot commun et certains d'entre eux causent des pertes économiques considérables (Caixeta et al., 2003). Les facteurs abiotiques tels que les hautes températures et la sècheresse contribuent aussi à réduire les rendements du haricot (Rainey et al., 2005).
2Dans les travaux d'amélioration variétale du haricot commun, les hybrides interspécifiques ont été exploités pour introduire des gènes utiles qui sont absents ou faiblement exprimés chez cette légumineuse. Les croisements ont été réalisés surtout avec les deux espèces donneuses Phaseolus coccineus L. et Phaseolus polyanthus Greenm. phylétiquement les plus proches de Phaseolus vulgaris. Ces deux espèces sont utilisées comme parents maternels afin de favoriser l'introgression des gènes utiles de ces deux taxons. Malheureusement, ces croisements donnent lieu très souvent à des avortements très précoces des embryons hybrides (Busogoro et al., 1999 ; Baudoin et al., 2004).
3L'avortement des embryons hybrides est attribué en partie à des raisons nutritionnelles : les mauvais fonctionnements de l'albumen, du suspenseur et des tissus maternels entraineraient une compétition entre l'albumen et l'embryon d'une part, et entre le suspenseur et l'embryon d'autre part. Ces différentes anomalies entravent l'alimentation normale de l'embryon hybride et le maintien d'un équilibre minéral et hormonal nécessaire au métabolisme de l'embryogenèse (Geerts et al., 2002 ; Toussaint et al., 2004). L'utilisation de l'embryoculture a permis la régénération de plantes hybrides issues de ces différents croisements. Les embryons hybrides mis en culture étaient âgés de 7 à 33 jours et avaient tous atteint le stade cordiforme tardif ou cotylédonaire (Camarena et al., 1987 ; Kuboyama et al., 1991).
4Par ailleurs, l'identification des gènes majeurs impliqués dans l'embryogenèse de Phaseolus permettrait d'avoir une meilleure compréhension du phénomène d'avortement des embryons.
5Comme cela s'est fait chez des plantes modèles (Devic, 1995 ; McElver et al., 2001 ; Tzafrir et al., 2004 ; Vernoud et al., 2005), les mutations induites (provoquées par des agents extérieurs et causant des modifications dans le génome) pourraient être utilisées chez Phaseolus pour identifier les gènes majeurs intervenant dans l'embryogenèse.
6L'objet de cette étude est de montrer que l'utilisation des mutations induites chez le haricot commun permettrait de mieux comprendre les mécanismes fondamentaux conduisant à l'avortement des embryons au cours du développement embryonnaire chez Phaseolus. Dans un premier temps, nous décrirons les mutations induites au niveau de l'embryogenèse des plantes ainsi que les types de mutations utilisés chez les plantes modèles pour l'identification des gènes de l'embryogenèse. Ensuite, quelques cas d'études réalisées chez deux plantes modèles, Arabidopsis thaliana (L.) Heyhn. (dicotylédone) et Zea mays L. (monocotylédone), sont présentés. Nous faisons également une synthèse de quelques mutants affectés dans la signalisation de l'auxine chez Arabidopsis. Dans la dernière partie, nous présentons quelques exemples d'utilisation des mutations induites chez le haricot commun et leur potentialité dans l'étude de l'embryogenèse.
2. Les mutations induites et l'embryogenèse des plantes modèles
2.1. Les mutations induites
7Les mutations induites sont provoquées par l'action d'agents mutagènes ou d'éléments d'ADN transposables afin de créer et d'augmenter la variabilité au sein d'une population. D'une façon générale, les mutations entrainent des modifications dans n'importe quelle région de l'ADN. Ces modifications se caractérisent soit par des gains ou des pertes de fonction. L'exploitation des mutants permet de localiser et d'identifier des gènes affectés et de déterminer leur fonction biologique (Meunier, 2005).
8Les agents mutagènes sont des produits chimiques ou des facteurs physiques dont les actions sont aléatoires ; n'importe quelle partie du génome ou gène peut subir une modification (Morère et al., 2003). Il existe une spécificité des agents mutagènes dans la mesure où, pour un agent mutagène donné, certains changements de séquence sont privilégiés par rapport aux autres changements possibles. La mutagenèse peut cependant se réaliser par insertion d'éléments étrangers ou non (ADN-T ou transposons) dans le génome d'un organisme, il s'agit de la mutagenèse insertionnelle (Parinov et al., 2000 ; McElver et al., 2001).
2.2. L'embryogenèse des plantes à fleurs
9Chez les angiospermes (plantes à fleurs), l'embryogenèse est constituée de trois étapes majeures (Park et al., 2008). La première étape comporte la formation du patron de l'embryon. Ce dernier passe par différents stades de développement nommés en fonction de la forme de l'embryon : le zygote, une seule cellule, se divise activement pour former des embryons préglobulaires (le quadrant, un embryon de 4 cellules ; l'octant, un embryon de 8 cellules, etc.). L'embryon passera ensuite par les différents stades globulaires, triangulaires, cordiformes, torpilles et cotylédonaires. La formation du patron est achevée dans l'embryon au stade cordiforme correspondant à l'embryogenèse précoce. Les cellules qui donneront les différents méristèmes et tissus sont alors positionnées. Ce patron sert de base aux étapes ultérieures de l'embryogenèse et à la formation de la plante adulte. La deuxième phase correspond à une étape de croissance et de maturation pendant laquelle l'embryon emmagasine des réserves pour assurer la germination après la dormance. La dernière étape correspond à la dormance qui est un état de repos végétatif permettant aux graines d'attendre les bonnes conditions climatiques pour germer. Ces trois étapes se déroulent de manière séquentielle et chaque phase de développement nécessite l'expression de différents groupes de gènes (Devic et al., 2001 ; McElver et al., 2001). La figure 1a représente les différentes phases de l'embryogenèse chez A. thaliana ainsi que les principaux gènes impliqués.
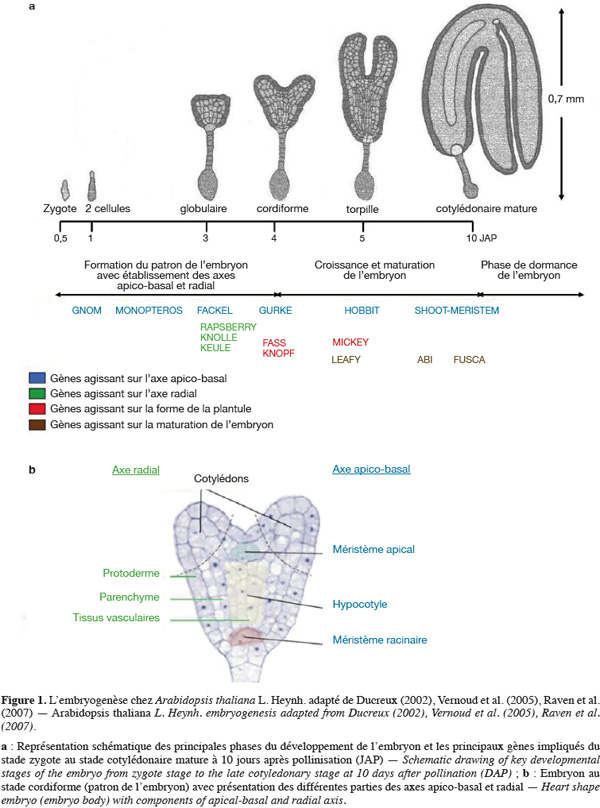
10Malgré des différences morphologiques importantes, les plans d'organisation et la séquence des évènements aboutissant à l'embryon mature sont globalement conservés pour l'ensemble des plantes, qu'elles soient monocotylédones ou dicotylédones. L'embryogenèse de ces deux classes de plantes est même parfaitement comparable jusqu'au stade 8 cellules. Ainsi, chez le maïs qui constitue la plante modèle pour l'étude de l'embryogenèse des monocotylédones (Fontanet et al., 2008), le développement embryonnaire suit, dans l'ensemble, le même schéma que chez A. thaliana. Toutefois, quelques différences existent :
11– le développement du maïs s'effectue selon un plan de division différent de celui d'Arabidopsis, l'embryon et le suspenseur résultant tous deux d'une série de divisions asymétriques,
12– chez le maïs, l'axe établi par les méristèmes caulinaire et racinaire de l'embryon est oblique par rapport à l'axe embryon-suspenseur, alors que ces deux axes sont confondus chez Arabidopsis,
13– chez le maïs, il n'y a qu'un seul cotylédon (appelé scutellum) sur l'axe duquel se situe le méristème apical ; chez Arabidopsis, par contre, deux cotylédons sont positionnés de façon symétrique autour de l'axe,
14– dans le cas du maïs, le méristème apical commence à produire des feuilles durant le développement embryonnaire, l'entrée en dormance de la graine ayant lieu lorsque la plantule est constituée de 6 primordia foliaires ; chez A. thaliana, les premières feuilles n'apparaissent qu'après la germination de la graine,
15– enfin, chez le maïs, les réserves sont accumulées au sein de l'albumen, qui constitue la plus grande partie du grain à maturité, d'où la dénomination de grain albuminé. En revanche, la graine d'Arabidopsis où les réserves sont contenues au sein même de l'embryon est une graine exalbuminée, tout comme pour le haricot commun.
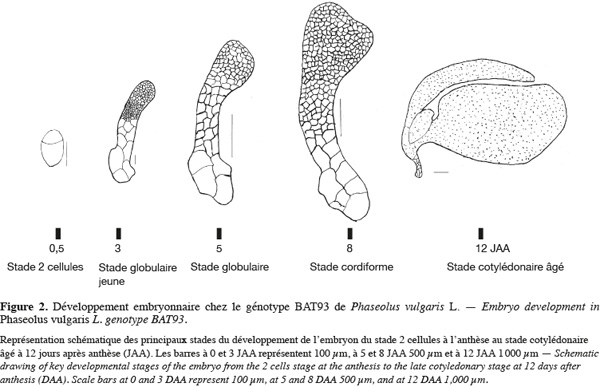
16Chez cette dernière espèce, les études antérieures sur l'embryogenèse ont montré que le développement embryonnaire suivait le même plan d'exécution que celui observé chez Arabidopsis (Yeung et al., 1979 ; Geerts, 2001 ; Nguema et al., 2007). Chez P. vulgaris, le stade cordiforme correspondant à la formation du patron de l'embryon est atteint 8 jours après l'anthèse. La figure 2 montre les différents stades de l'embryogenèse chez le génotype BAT93 de P. vulgaris, cultivé en chambre conditionnée à Gembloux (températures jour/nuit :24/20 °C, photopériode jour/nuit de 12 h/12 h, humidité relative : 75 %). Cette représentation schématique a été faite à partir de coupes histologiques. Les graines en développement ont été fixées dans 2 % de paraformaldéhyde préparé dans 0,1 M de tampon phosphate. Les échantillons sont ensuite déshydratés dans un gradient croissant d'éthanol et enrobés dans une résine méthacrylique hydrophile : le 2-hydroxyethyl methacrylate (HEMA). Enfin, des coupes de 5 à 7 μm sont effectuées à l'aide d'un microtome rotatif (Silué, 2009).
17L'embryogenèse précoce est une étape de morphogenèse qui aboutit à la formation de deux axes, un axe radial qui traduit la mise en place des différents tissus (l'épiderme, le parenchyme, le cortex, l'endoderme, le péricycle et les tissus vasculaires) et un axe apico-basal correspondant à la mise en place des différents organes [le méristème apical, le(s) cotylédon(s), l'hypocotyle situé sous les cotylédons, la radicule et le méristème racinaire] (Figure 1b). C'est au cours du passage du stade globulaire à l'émergence du ou des cotylédon(s) qu'apparait le plan apico-basal de l'embryon, bien que les premiers signes de polarité selon cet axe soient observables dès la première division du zygote, tandis que l'axe radial n'est défini qu'au stage globulaire (Raven et al., 2007). Au niveau de l'évolution et de la sélection naturelle, les individus les plus aptes à survivre seront ceux qui pourront plus facilement capter la lumière (seront donc plus hauts que leurs voisins) et qui sauront mieux coloniser le sol à la recherche de nutriments (possédant un système racinaire mieux adapté). Ces caractéristiques fondamentales résultent d'un bon établissement de l'axe apico-basal au cours de l'embryogenèse (Devic, 1995), soulignant ainsi l'intérêt de la compréhension des mécanismes génétiques de l'embryogenèse.
3. Les mutants embryons chez les plantes modèles
18Au cours de l'embryogenèse, de nombreux gènes doivent s'exprimer pour permettre au zygote de se diviser de manière régulière, de compléter sa morphogenèse et de se différencier en un embryon mature capable de surmonter la dessiccation et de produire une plante viable (McElver et al., 2001).
19La majorité des connaissances actuelles sur le programme génétique de l'embryogenèse des végétaux supérieurs provient de l'étude de mutants. De tels mutants affectant le développement embryonnaire à différents stades de développement ont été identifiés chez les plantes modèles Arabidopsis thaliana L. et Zea mays L. ayant subi différents types de mutagenèse : chimique, insertionnelle ou physique (Parinov et al., 2000 ; Till et al., 2004). Les agents mutagènes les plus utilisés sont l'Éthyle Méthane Sulfonate (EMS) pour la mutagenèse chimique, l'ADN-T et les transposons pour la mutagenèse insertionnelle, les rayons X et gamma pour la mutagenèse physique (McElver et al., 2001 ; Vernoud et al., 2005).
3.1. Les mutants embryons chez Arabidopsis thaliana
20Chez Arabidopsis, de nombreux mutants affectant différents évènements au cours de l'embryogenèse ont été isolés par mutagenèse induite. Deux stratégies complémentaires, basées sur le criblage phénotypique de siliques immatures (Meinke, 1985) et de plantules en germination (Jürgens et al., 1991), ont été employées afin d'isoler des mutants altérés au niveau de la phase d'embryogenèse précoce. En fonction des données issues de ces deux approches de mutagenèse (chimique et insertionnelle), le nombre de gènes essentiels au bon développement de la graine a fait l'objet d'évaluations. Grâce à l'analyse d'un grand nombre de mutants embryon-létaux, McElver et al. (2001) et Tzafrir et al. (2003) ont estimé qu'environ 750 gènes étaient indispensables pour coordonner les différents aspects du développement embryonnaire. Par contre, Tzafrir et al. (2004) répertorient le nombre de 250 gènes dont la mutation entrainerait des phénotypes embryon-létaux chez Arabidopsis.
21Récemment, le nombre de mutants embryon-létaux a été estimé à près de 550 dont plus de 88 % sont issus de la mutagenèse insertionnelle (principalement avec du T-DNA) et près de 10 % sont issus de la mutagenèse chimique à l'EMS (www.seedgenes.org). Les anomalies répertoriées chez les embryons mutants sont de trois types, selon qu'elles touchent la polarité apico-basale, l'organisation radiale ou les étapes post-embryonnaires (Ducreux, 2002).
22Les mutants de l'axe apico-basal. L'axe apico-basal, qui constitue l'axe principal de croissance des racines et des pousses végétatives après la germination, est le plus précoce à s'établir. Les altérations de cet axe donnent des plantules incomplètes, dépourvues soit des racines, soit de l'hypocotyle, ou de parties aériennes.
23Les mutations dans le gène GNOM (EMB30) chez Arabidopsis provoquent la disparition des parties apicale et basale de l'embryon qui présente une élongation réduite selon l'axe apico-basal (Jürgens et al., 1991 ; Shevell et al., 1994). Par la suite, ces embryons montrent des défauts le long de cet axe. Ainsi, les plantules gnom ne possèdent pas de racines, montrent un alignement des cellules vasculaires défectueuses et ont des structures apicales réduites. Le gène GNOM possède une forte similarité avec deux gènes de la levure, Gea1p et Gea2p (Busch et al., 1996). Ces gènes codent pour des protéines de type « membrane-associated guanine-nucleotide exchange factor » qui agissent sur l'ADP-ribosylation factor 1 (ARF), une protéine nécessaire à la formation des vésicules membranaires. Ainsi, le gène GNOM pourrait intervenir dans le transport dirigé de vésicules, notamment pour l'exportation des matériaux nécessaires à la croissance de la paroi cellulaire. Les constituants ainsi exportés pourraient stabiliser l'axe apico-basal (Shevell et al., 2000).
24Chez les mutants gurke, la partie supérieure de la plantule est affectée, les mutants étant réduits à l'hypocotyle et à la racine sans cotylédons ni méristème apical. Cela est dû à des divisions cellulaires non organisées (Torres-Ruiz et al., 1996). Le gène GURKE joue donc un rôle indispensable dans la mise en place des cotylédons et du méristème apical. Ce gène code pour une acetyl-CoA carboxylase 1 (ACCase 1) (Baud et al., 2004).
25Les mutations dans FACKEL affectent l'hypocotyle et donnent une plantule ayant les structures apicales (cotylédons) rattachées aux structures basales (racines) (Jürgens et al., 1991). Ce gène code pour une stérol C-14 réductase (Schrick et al., 2000). Les défauts observés seraient induits par la diminution des stérols en aval de la réaction impliquant la stérol C-14 réductase. Le gène FACKEL jouerait un rôle dans la structure cellulaire ou dans la signalisation embryonnaire (Jang et al., 2000 ; Schrick et al., 2000).
26Les mutants de l'axe radial. Le patron radial de l'embryon est composé de trois tissus de base : le protoderme (précurseur de l'épiderme), le parenchyme et le tissu vasculaire. Les altérations de l'organisation radiale sont des mutations qui affectent la distribution et l'organisation des trois tissus cités ci-dessus.
27Les gènes KNOLLE et KEULE d'Arabidopsis thaliana constituent deux gènes dont la mutation perturbe la différenciation tissulaire lors de l'établissement du protoderme. Chez les mutants knolle, la séparation cellulaire est perturbée, tandis que la formation de la plaque cellulaire est anormale chez les mutants keule, donnant ainsi des embryons avec des cellules multinucléées (Assaad et al., 2001). Les produits de ces deux gènes sont respectivement une syntaxine et une protéine SEC1. La syntaxine est une protéine nécessaire pour la formation de la plaque de cellules, tandis que la protéine SEC1 régule le fonctionnement de la syntaxine (Assaad et al., 2001 ; Haga et al., 2007). Les deux gènes KNOLLE et KEULE interagissent entre eux et sont indispensables à la séquestration, au transport et à la fusion des vésicules golgiennes lors de la cytokinèse (Heese et al., 2001). Au sein de l'axe radial de l'embryon, une cytokinèse complète est nécessaire à la ségrégation physique des déterminants définissant le devenir des cellules internes et protodermiques (Laux et al., 1997).
28La caractérisation phénotypique de mutants embryo-défectueux a aussi révélé que si la différenciation tissulaire pouvait se dérouler indépendamment de la morphogenèse (par exemple, chez le mutant gnom ou fackel), en revanche, la morphogenèse ne peut avoir lieu sans qu'il y ait différenciation cellulaire (Goldberg et al., 1994). Ainsi, alors que la perte d'un domaine embryonnaire n'altère pas l'élaboration des différentes couches de tissus dans les autres régions de l'embryon, le bon établissement de l'axe radial semble indispensable à la construction correcte de l'axe apico-basal, les cellules au sein de l'axe radial interagissant probablement entre elles le long de l'axe principal de l'embryon (Ben, 2005).
29Les mutations post-embryonnaires. Concernant les anomalies post-embryonnaires, les gènes LEAFY COTYLEDON (LEC) sont en particulier impliqués dans les processus de mise en réserve et d'entrée en dormance (Kwong et al., 2003 ; Kagaya et al., 2005). Ces gènes codent pour des facteurs de transcriptions et contrôlent différents aspects de l'embryogenèse lors de la maturation de l'embryon (Kwong et al., 2003). Les mutants lec ont des cotylédons en forme de feuilles. Les graines matures lec contiennent de la chlorophylle et ne se dessèchent pas (To et al., 2006).
3.2. Les mutants embryons chez Zea mays
30Chez le maïs, les mutants affectant le développement embryonnaire ont été obtenus soit par mutagenèse à l'EMS, soit par mutagenèse de transposition. Les éléments transposables actifs sont généralement de trois types : Mutator (Mu), Activator (Ac) ou Enhancer (En) (Till et al., 2004 ; Vernoud et al., 2005). Deux classes principales de mutants ont été identifiées : les mutants dek (defective-kernel : grain altéré) altérés au niveau de l'embryon et de l'albumen (Neuffer et al., 1980) et les mutants emb (embryonic defective) pour lesquels seul l'embryon est affecté (Clark et al., 1991). Parmi les mutants emb, les mutations concernent soit la mise en place du patron embryonnaire, soit la croissance cellulaire ou le métabolisme. Les mutations dek sont récessives et constituent la majeure partie des mutants du développement embryonnaire (Vernoud et al., 2005).
31Les mutants empty pericarp (emp) appartiennent à la classe des mutants dek et représentent environ 10 % de ces mutants. Chez ceux-ci, les graines sont caractérisées par un volume très réduit de l'albumen, qui n'est visible que 12 jours après pollinisation (JAP) ; ces graines sont également dépourvues de péricarpe. Une étude histologique révèle un développement partiel des domaines de l'albumen et les embryons semblent freinés dans leur croissance, tandis que leur morphogenèse n'est pas affectée (Dolfini et al., 2007). Le gène EMPTY PERICARP 2 code pour une protéine ayant une forte homologie avec la protéine HEAT SHOCK BINDING PROTEIN 1 (HSBP1), qui est un régulateur négatif de la réponse au choc thermique chez le maïs (Fu et al., 2002). Les mutants emp2 sont donc issus d'une modification dans le gène codant pour la protéine HSBP1.
32Chez les mutants du groupe emb, les mutants emb8516 présentent des anomalies dès le stade transition de l'embryon (6 JAP). Les jeunes embryons mutants sont caractérisés par des protubérances (semblables à des embryons) à l'extrémité du suspenseur, aboutissant finalement à des structures de forme irrégulière et de taille variable. L'absence du cotylédon (ou scutellum) témoigne de l'absence de morphogenèse à l'extrémité supérieure de l'embryon. La caractérisation du gène mis en cause montre qu'il code pour une protéine ayant une forte homologie avec la protéine L35 de la grande sous-unité des ribosomes plastidiaux. Cette protéine est codée par le gène ZmPRPL35-1 du maïs (Magnard et al., 2004) et les mutants seraient donc issus d'un dysfonctionnement de ce gène.
3.3. Les mutants embryonnaires affectés dans la signalisation de l'auxine chez Arabidopsis
33L'auxine (AIA : acide b-indolyl-acétique) est une hormone de croissance végétale impliquée dans de nombreux aspects du développement des plantes dont l'embryogenèse et la formation de l'axe apico-basal (Friml et al., 2003). Cette molécule signal est impliquée dans la mise en place de différentes régions de l'embryon à différents stades du développement. Elle est en particulier liée à la spécification de la cellule apicale issue de la première division zygotique et à l'établissement de la symétrie bilatérale (Al-Hammadi et al., 2003). Les étapes cruciales de l'embryogenèse précoce coïncident avec l'accumulation dynamique de l'hormone à des endroits spécifiques de l'embryon, liée à un transport localisé le long de l'axe apico-basal grâce à des protéines d'influx AUXIN RESISTANT (AXR) (Kramer, 2004) et d'efflux PIN-FORMED (PIN) (Zažímalová et al., 2007) et PhosphoGlycoProtein (PGP) (Blakeslee et al., 2007). L'AIA peut aussi agir au niveau de l'expression génétique en se liant à des protéines cytosoliques ARF (Auxin Response Factor). Ce sont des facteurs de transcription qui se fixent à l'ADN sur une séquence spécifique ARE (Auxin Response Element). Cette séquence (TGTC) se retrouve dans les séquences promotrices des gènes dont la transcription est influencée par l'auxine (Okushima et al., 2005).
34Plusieurs gènes sont impliqués dans la réponse à l'auxine au cours de l'embryogenèse. L'identification de mutants embryo-défectueux affectés dans le transport ou la signalisation de l'auxine tels que les mutants gnom, monopteros, pin-formed1 ou encore bodenlos, indique que l'auxine joue un rôle capital dans la coordination de l'organisation de l'embryon (Weijers et al., 2005). MONOPTEROS (MP) et BODENLOS (BDL) sont des protéines indispensables au flux correct et à la localisation coordonnée de l'auxine pendant l'embryogenèse. Ainsi MP, qui code pour le facteur de transcription ARF5, est capable de se lier à des éléments de promoteurs de gènes inductibles par l'auxine et est impliqué très précocement dans la mise en place du schéma d'organisation de l'embryon (Ulmasov et al., 1999). BDL code pour la protéine IAA12, un inhibiteur potentiel de MP dont la dégradation suite à un signal auxinique intracellulaire induit l'activation par MP de gènes cibles tels que des membres de la famille de protéines à homéodomaines du type HD-Zip requis pour la formation du tissu vasculaire (Hamann et al., 2002). MP et BDL sont co-exprimés au cours de l'embryogenèse : leurs ARNm, initialement accumulés de manière homogène au sein de la cellule apicale du proembryon et de ses dérivés, sont graduellement limités au niveau du futur tissu vasculaire, c'est-à-dire dans les cellules internes du proembryon. Ces gènes sont également exprimés dans la partie supérieure de l'hypophyse (zone située entre l'embryon et le suspenseur) où ils participeraient au contrôle de la différenciation cellulaire. Les gènes régulés par l'auxine et à l'origine de devenirs cellulaires particuliers dans l'embryon pourraient donc être des gènes activés par MP de façon BDL-dépendante. Au sein de l'embryon, la réponse à l'auxine MP/BDL-dépendante pourrait s'effectuer soit directement par migration des protéines le long de l'axe principal du proembryon induisant la spécification successive des différentes régions, soit grâce à l'activation d'un messager secondaire mobile agissant au niveau de l'hypophyse (Weijers et al., 2005).
35Les embryons mutants monopteros sont anormaux depuis le stade 8 cellules et présentent des cellules centrales et basales qui se divisent anormalement. La plantule n'a pas d'hypocotyle, ni de racine, ni de méristème racinaire (Berleth et al., 1993). Le développement correct des structures basales se ferait donc par un processus dépendant de l'auxine. Le phénotype des mutants pinoid, pin-formed et monopteros, caractérisé par des malformations des cotylédons ou leur fusion, témoigne du rôle joué par l'auxine lors de la transition de symétrie radiale à bilatérale. Ces gènes seraient nécessaires pour le transport correct et la localisation coordonnée de l'auxine.
36Le gène GNOM joue un rôle dans la localisation du transporteur PIN1 qui intervient dans l'efflux de l'auxine dans la partie basale des cellules. Ce gène est requis pour le transport polaire de l'auxine et l'établissement de la polarité embryonnaire. Les transporteurs PIN qui sont actuellement au nombre de huit sont localisés de manière polarisée sur une face des cellules et assurent un efflux d'auxine (Wisniewska et al., 2006). La mutation du gène GNOM perturbe la polarité du transport de l'auxine en bloquant le recyclage des protéines PIN1 vers la membrane plasmique (Geldner et al., 2001). Le gène PIN7 est initialement exprimé dans la cellule basale du zygote où son expression est limitée au niveau de la paroi cellulaire apicale. À ce niveau, il assure le passage de l'auxine vers la cellule apicale où un pic d'auxine est observé. Chez les mutants pin7, les divisions cellulaires sont aberrantes au niveau de la cellule apicale, la paroi cellulaire entre la cellule apicale et la cellule basale n'est pas parfaitement définie (Friml et al., 2003).
37Le gène AUXIN RESISTANT 6 (AXR6) codant pour une sous-unité de la ligase de l'ubiquitine SKP1/CULLIN/F-BOX pourrait être impliqué dans la dégradation de protéines IAA en réponse à la signalisation auxinique (Hellmann et al., 2003). La mutation de AXR6 entraine une réponse réduite à l'auxine et un phénotype similaire à celui observé chez les mutants mp et bdl d'Arabidopsis (pas de racine, un seul cotylédon, défauts dans les tissus vasculaires). Il agirait de concert avec ces deux gènes dans la voie de la réponse à l'auxine au cours du développement embryonnaire. AXR6 montre que l'auxine est également indispensable pour des divisions cellulaires correctes et le devenir cellulaire du suspenseur (Souter et al., 2000).
4. Application des mutations induites au haricot commun
38Chez le haricot commun, les mutations induites sont utilisées soit dans la recherche de variétés performantes au niveau du rendement et de la résistance et/ou de la tolérance aux contraintes biotiques et abiotiques, soit dans l'étude de processus biologiques tels que la nodulation, la floraison, la synthèse des acides gras, l'embryogenèse, etc. (Maluszynski et al., 2000 ; Park et al., 2006 ; Silué et al., 2006 ; Chen et al., 2009).
39En raison de l'impossibilité de mettre au point un protocole de transformation du haricot commun, les techniques de mutagenèse insertionnelle par transposon ou ADN-T ne peuvent être valorisées avec succès chez P. vulgaris. La mutagenèse chimique à l'EMS a été la plus fructueuse lors d'expériences menées dans différents laboratoires (Pankhurst et al., 2004 ; Park et al., 2006). Le processus biologique le plus étudié à travers ces mutations induites chez le haricot commun est la nodulation. En effet, plusieurs mutants de ce caractère ont été isolés, allant des mutants qui ne forment pas de nodules, à ceux dont les nodules ne sont pas fonctionnels et donc incapables de fixer l'azote atmosphérique (Pedalino et al., 1992 ; Pankhurst et al., 2004 ; Park et al., 2006).
40Un projet de TILLING a été initié chez P. vulgaris sur la base de la mutagenèse à l'EMS ; c'est une collaboration entre l'Université de Genève (Suisse) et les structures de recherche de l'USDA/ARS/TARS (United States Departement of Agriculture/Agricultural Research Service/Tropical Agriculture Research Station, Mayagüez, Puerto Rico) et du CIAT (Centro Internacional de Agricultura Tropical, Cali, Colombia). Le génotype BAT93 d'origine mésoaméricaine et résistant à plusieurs maladies (Broughton et al., 2003) a servi de matériel biologique. Sur la base des études menées chez l'espèce Lotus japonicus L. (Perry et al., 2003), il faudrait environ 5 000 lignées mutantes pour arriver à la saturation du génome de BAT93 avec la mutagenèse à l'EMS. À ce jour, près de 1 500 familles M2 ont été produites ; après analyse de 348 familles M2, 10 % des mutants étaient déficients dans la formation des nodules (Gepts et al., 2008).
41Une autre étude a été menée sur une partie de la population de plantes de BAT93 issues de la mutagenèse. Ce travail est le fruit d'une collaboration entre l'Unité de Phytotechnie tropicale et d'Horticulture de l'Université de Liège-Gembloux Agro-Bio Tech et du Laboratoire de Biologie moléculaire des Plantes supérieures de l'Université de Genève. Cette étude avait pour objet de sélectionner des plantes déficientes dans la formation de graines matures, afin d'isoler des embryons qui avortent avant la maturité. Sur un total de 365 plantes M2 issues de 60 familles, 2 plantes d'une même famille ont présenté cette anomalie recherchée : leurs embryons n'arrivent pas à maturité. Les phénotypes présentés par les embryons sont les mêmes chez les deux plantes. Ces embryons présentent un retard de croissance et se caractérisent par des anomalies au niveau des cotylédons et du suspenseur. Les anomalies cotylédonaires se manifestent de différentes façons : cotylédons fusionnés, surnuméraires, ou de tailles différentes. Les suspenseurs de ces embryons étaient de plus grande taille que ceux des embryons normaux, entrainant ainsi un retard de croissance de ces embryons et leur avortement (Silué et al., 2006). Ces plantes qui produisent des graines avortant avant maturité sont actuellement maintenues en chambre conditionnée à Gembloux grâce à des hybridations avec des plantes normales non mutagénisées de la variété BAT93. Le déterminisme génétique du caractère « avortement des embryons » a été évalué sur des hybrides F2 issues des croisements entre les plantes d'intérêt issues de la mutagenèse et des plantes non mutagénisées du génotype BAT93 de P. vulgaris. L'analyse de la F1 montre que la transmission de ce caractère est maternelle. En effet, lorsque les plantes mutées sont utilisées comme parents femelles, toutes les graines F1 produites avortent avant la maturité, comme c'est le cas chez les plantes mutées. Par contre, lorsque ces plantes sont utilisées comme parents mâles, toutes les graines F1 produites arrivent à maturité, germent et donnent des plantes F1 fertiles. Les graines F2 produites sont également fertiles et un total de 96 plantes F2 ont été observées pour déterminer la proportion de plantes normales et de plantes anormales. Cette analyse préliminaire a révélé une ségrégation mendélienne 3:1 de plantes normales et anormales, montrant ainsi que ce caractère serait gouverné par un allèle récessif. Des ADNc différemment exprimés dans les graines en voie d'avortement ont été mis en évidence en utilisant la technique de l'Hybridation Soustractive Suppressive (HSS). Dix protéines ont été identifiées dont les principales sont le cytochrome P450, la myo-inositol 1-phosphate synthase, la peroxidase cationique, le voltage-dependent anion channel et la sucrose synthase (Silué, 2009).
5. Conclusion et perspectives
42La mutagenèse induite est utilisée chez plusieurs espèces végétales pour l'étude de processus biologiques tels que la formation des nodules, la floraison, la synthèse des acides gras, l'embryogenèse, etc. Chez les plantes modèles Arabidopsis thaliana et Zea mays, la mutagenèse insertionnelle (ADN-T ou transposon) et la mutagenèse chimique à l'EMS ont permis d'isoler des mutants embryon-létaux. Ces techniques couplées à la génétique directe et la génétique inverse ont permis d'identifier de nombreux gènes indispensables au bon déroulement de l'embryogenèse chez les plantes. Les premières études de l'embryogenèse menées chez le haricot commun par l'utilisation de la mutagenèse chimique ont permis d'isoler des plantes mutagénisées qui produisent des embryons qui avortent avant la maturité. Nous pouvons donc dire que la mutagenèse à l'EMS est un bon outil pour l'induction de mutation dans les génomes des organismes vivants. À l'image des espèces A. thaliana et Z. mays, pour lesquelles la mutagenèse à l'EMS est utilisée avec succès dans l'étude de l'embryogenèse, cette technique peut être exploitée dans la mise en évidence des gènes importants pour le développement normal de l'embryon chez Phaseolus. Chez ces deux plantes modèles, les mutants emb, où seul l'embryon est affecté, ont été identifiés. Ceci montre qu'il y aurait conservation du processus amenant aux mutants emb chez ces deux espèces. Ces exemples d'études faites chez ces deux espèces pourraient être transposés chez le haricot commun.
Bibliographie
Al-Hammadi A.S.A. et al., 2003. The polycotyledon mutant of tomato shows enhanced polar auxin transport. Plant Physiol., 133, 113-125.
Assaad F.F., Huet Y., Mayer U. & Jürgens G., 2001. The cytokinesis gene KEULE encodes a Sec1 protein that binds the syntaxin KNOLLE. J. Cell Biol., 152, 531-543.
Baud S. et al., 2004. Gurke and pasticcino3 mutants affected in embryo development are impaired in acetyl-CoA carboxylase. EMBO Rep., 5, 515-520.
Baudoin J.-P. et al., 2004. Interspecific hybridization with Phaseolus vulgaris L.: embryo development and its genetics. In: Pandalai S.G., ed. Recent research developments in genetics and breeding. Vol. 1. Part 2. Kerala, India: Research Signpost, Trivandrum, 349-364.
Ben C., 2005. Analyse du transcriptome lors de l'embryogenèse précoce chez le tournesol. Thèse de doctorat : École Nationale Supérieure Agronomique de Toulouse (France).
Berleth T. & Jürgens G., 1993. The role of the monopteros gene in organizing the basal body region of the Arabidopsis embryo. Development, 118, 575-587.
Blakeslee J.J. et al., 2007. Interactions among PIN-Formed and P-glycoprotein auxin transporters in Arabidopsis. Plant Cell, 19, 131-147.
Broughton W.J. et al., 2003. Beans (Phaseolus spp.) model food legumes. Plant Soil, 252, 55-128.
Busch M., Mayer U. & Jürgens G., 1996. Molecular analysis of the Arabidopsis pattern formation gene GNOM: gene structure and intragenic complementation. Mol. Gen. Genet., 250, 681-691.
Busogoro J.P., Jijakli M.H. & Lepoivre P., 1999. Identification of a novel source of resistance to angular leaf spot disease of common bean within the secondary gene pool. Plant Breeding, 118, 417-423.
Caixeta E.T. et al., 2003. Inheritance of angular leaf spot resistance in common bean line BAT 332 and identification of RAPD marker linked to the resistance gene. Euphytica, 134, 297-303.
Camarena M.F. & Baudoin J.-P., 1987. Obtention des premiers hybrides interspécifiques entre Phaseolus vulgaris et Phaseolus polyanthus avec le cytoplasme de cette dernière forme. Bull. Rech. Agron. Gembloux, 22, 43-55.
Chen M. et al., 2009. System analysis of an Arabidopsis mutant altered in de novo fatty acid synthesis reveals diverse changes in seed composition and metabolism. Plant Physiol., 150, 27-41.
Clark J.K. & Sheridan W.F., 1991. Isolation and characterisation of 51 embryo-specific mutations of maize. Plant Cell, 3, 935-951.
Devic M., 1995. L'embryogenèse d'Arabidopsis. Biofutur, 151, 32-37.
Devic M. & Guilleminot J., 2001. Approches de génomique fonctionnelle appliquées à l'étude de l'embryogenèse précoce. École thématique de biologie végétale, http://www.isv.cnrs-gif.fr/ebv/devic.pdf, (10/05/2010).
Dolfini S. et al., 2007. A mutational approach to the study of seed development in maize. J. Exp. Bot., 58, 1197-1205.
Ducreux G., 2002. Introduction à la botanique. Paris : Belin.
FAO, 2009. Preliminary 2009 data now available for selected countries and products, http://faostat.fao.org/site/567/default.aspx, (11/01/2010).
Fontanet P. & Vicient C.M., 2008. Maize embryogenesis. In: Suárez M.F. & Bozhkov P.V., eds. Plant embryogenesis. Totowa, NJ, USA: Springer, Humana Press, 17-29.
Friml J. et al., 2003. Efflux-dependent auxin gradients establish the apical-basal axis of Arabidopsis. Nature, 426, 147-153.
Fu S., Meeley R. & Scanlon J., 2002. Empty pericarp2 encodes a negative regulator of the heat shock response and is required for maize embryogenesis. Plant Cell, 14, 3119-3132.
Geerts P., 2001. Study of embryo development in Phaseolus in order to obtain interspecific hybrids. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgium).
Geerts P., Toussaint A., Mergeai G. & Baudoin J.-P., 2002. Study of the early abortion in reciprocal crosses between Phaseolus vulgaris L. and Phaseolus polyanthus Greenm. Biotechnol. Agron. Soc. Environ., 6, 109-119.
Geldner N. et al., 2001. Auxin transport inhibitors block PIN1 cycling and vesicle trafficking. Nature, 413, 425-428.
Gepts P. et al., 2008. Genomics of Phaseolus beans, a major source of dietary protein and micronutrients in the tropics. In: Moore P.H. & Ming R., eds. Genomics of tropical crop plants. New York, USA: Springer, 113-143.
Goldberg R.B., de Pavia G. & Yadegari R., 1994. Plant embryogenesis: zygote to seed. Science, 466, 605-614.
Haga N. et al., 2007. R1R2R3-Myb proteins positively regulate cytokinesis through activation of KNOLLE transcription in Arabidopsis thaliana. Development, 134, 1101-1110.
Hamann T. et al., 2002. The Arabidopsis BODENLOS gene encodes an auxin response protein inhibiting MONOPTEROS-mediated embryo patterning. Genes Dev., 16, 1610-1615.
Heese M. et al., 2001. Functional characterization of the KNOLLE-interacting t-SNARE AtSNAP33 and its role in plant cytokinesis. J. Cell Biol., 155, 239-249.
Hellmann H. et al., 2003. Arabidopsis AXR6 encodes CUL1 implicating SCF E3 ligases in auxin regulation of embryogenesis. EMBO J., 22, 3314-3325.
Jang J.C. et al., 2000. A critical role of sterols in embryonic patterning and meristem programming revealed by the fackel mutants of Arabidopsis thaliana. Genes Dev., 14, 1485-1497.
Jürgens G. et al., 1991. Genetic analysis of pattern formation in the Arabidopsis embryo. Development, 1, 27-38.
Kagaya Y. et al., 2005. LEAFY COTYLEDON1 controls seed storage protein genes through its regulation of FUSCA3 and ABSCISIC ACID INSENSITIVE3. Plant Cell Physiol., 46, 399-406.
Kramer E.M., 2004. PIN and AUX/LAX proteins: their role in auxin accumulation. Trends Plant Sci., 9, 578-582.
Kuboyama T., Shintaku Y. & Takeda G., 1991. Hybrid plant of Phaseolus vulgaris and P. lunatus L. obtained by means of embryo rescue and confirmed by restriction endonuclease analysis of rDNA. Euphytica, 54, 177-182.
Kwong R.W. et al., 2003. LEAFY COTYLEDON1-LIKE defines a class of regulators essential for embryo development. Plant Cell, 15, 5-18.
Laux T. & Jürgens G., 1997. Embryogenesis: a new start into life. Plant Cell, 9, 989-1000.
Magnard J.L. et al., 2004. Morphogenesis of maize embryos requires ZmPRPL35-1 encoding a plastid ribosomal protein. Plant Physiol., 134, 649-663.
Maluszynski M., Nichterlein K., van Zanten L. & Ahloowalia B.S., 2000. Officially released mutant varieties – the FAO/IAEA Database. Mutant Breed. Rev., 12, 1-84.
McElver J. et al., 2001. Insertional mutagenesis of genes required for seed development in Arabidopsis thaliana. Genetics, 159, 1751-1763.
Meinke D.W., 1985. Embryo-lethal mutants of Arabidopsis thaliana: analysis of mutants with a wide range of lethal phases. Theor. Appl. Genet., 69, 543-552.
Meunier E., 2005. Des plantes mutantes dans nos assiettes. Inf'OGM, 67, Septembre 2005, http://www.infogm.org/spip.php?article2406, (10/05/2010).
Morère J.L. & Pujol R., 2003. Dictionnaire raisonné de biologie. Paris : Frison-Roche.
Neuffer G. & Sheridan W.F., 1980. Defective kernel mutants of maize. I. Genetic and lethality studies. Genetics, 95, 929-944.
Nguema N.P., Toussaint A. & Baudoin J.-P., 2007. Embryogenèse précoce comparative lors des croisements entre Phaseolus coccineus L. et Phaseolus vulgaris L. Biotechnol. Agron. Soc. Environ., 11, 97-107.
Okushima Y. et al., 2005. Functional genomic analysis of the AUXIN RESPONSE FACTOR gene family members in Arabidopsis thaliana: unique and overlapping functions of ARF7 and ARF19. Plant Cell, 17, 444-463.
Pankhurst C., Blair M.W. & Broughton W.J., 2004. Tilling the beans. In: Hernandez G., Gerber D., Pankhurst C. & Broughton W., eds. Proceedings of the 3rd International Scientific Meeting, Phaseomics III, June 13-15, Geneva, Switzerland.
Parinov S. & Sundaresan V., 2000. Functional genomics in Arabidopsis: large scale insertional mutagenesis complements the genome sequencing project. Curr. Opin. Biotechnol., 11, 157-161.
Park S.J. & Buttery B.R., 2006. Registration of ineffective nodulation mutant R69 and non-nodulation mutant R99 common bean genetic stocks. Crop Sci., 46, 1415-1417.
Park S. & Harada J.J., 2008. Arabidopsis embryogenesis. In: Suárez M.F. & Bozhkov P.V., eds. Plant embryogenesis. Totowa, NJ, USA: Springer Humana Press, 3-16.
Pedalino M., Giller K.E. & Kipe-Nolt J., 1992. Genetic and physiological characterization of the non-nodulating mutant of Phaseolus vulgaris L. -NOD125. J. Exp. Bot., 43, 843-849.
Perry J.A. et al., 2003. A TILLING reverse genetics tool and a web-accessible collection of mutants of the legume Lotus japonicus. Plant Physiol., 131, 866-871.
Rainey K.M. & Griffiths P.D., 2005. Inheritance of heat tolerance during reproductive development in snap bean (Phaseolus vulgaris L.). J. Am. Soc. Hortic. Sci., 130, 700-706.
Raven P.H., Evert R.F. & Eichhorn S.E., 2007. Biologie végétale. Paris : De Boeck.
Schrick K. et al., 2000. FACKEL is a sterol C-14 reductase required for organized cell division and expansion in Arabidopsis embryogenesis. Genes Dev., 14, 1471-1484.
Shevell D.E. et al., 1994. EMB30 is essential for normal cell division, cell expansion, and cell adhesion in Arabidopsis and encodes a protein that has similarity to Sec 7. Cell, 77, 1051-1062.
Shevell D.E., Kunkel T. & Chua N.H., 2000. Cell wall alterations in the Arabidopsis emb30 mutant. Plant Cell, 12, 2047-2060.
Silué S., 2009. Mécanismes génétiques de l'embryogenèse chez Phaseolus et application en hybridation interspécifique. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Silué S. et al., 2006. Screening Phaseolus vulgaris L. EMS mutants to isolate plants which failed in seed development. Annu. Rep. Bean Improv. Coop., 49, 149-150.
Souter M. & Lindsey K., 2000. Polarity and signalling in plant embryogenesis. J. Exp. Bot., 51, 971-983.
Till B.J. et al., 2004. Discovery of induced point mutations in maize genes by TILLING. BMC Plant Biol., 4, 12.
To A. et al., 2006. A network of local and redundant gene regulation governs Arabidopsis seed maturation. Plant Cell, 18, 1642-1651.
Torres-Ruiz R.A., Lohner A. & Jürgens G., 1996. The GURKE gene is required for normal organisation of the apical region in the Arabidopsis embryo. Plant J., 10, 1005-1016.
Toussaint A. et al., 2004. Early abortion in reciprocal crosses between Phaseolus vulgaris and Phaseolus polyanthus, and in vitro culture of immature embryos from these species. Belg. J. Bot., 137, 47-54.
Tzafrir I. et al., 2003. The Arabidopsis seed genes project. Nucleic Acids Res., 31, 90-93.
Tzafrir I. et al., 2004. Identification of genes required for embryo development in Arabidopsis. Plant Physiol., 135, 1206-1220.
Ulmasov T., Hagen G. & Guilfoyle T.J., 1999. Activation and repression of transcription by auxin-response factors. Proc. Natl Acad. Sci. USA, 96, 5844-5849.
Vernoud V. et al., 2005. Maize embryogenesis. Maydica, 50, 469-483.
Weijers D. & Jürgens G., 2005. Auxin and embryo axis formation: the ends in sight? Curr. Opin. Plant Biol., 8, 32-37.
Wisniewska J. et al., 2006. Polar PIN localization directs auxin flow in plants. Science, 312, 883.
Yeung E.C. & Clutter M.E., 1979. Embryogeny of Phaseolus coccineus: the ultrastructure and development of the suspensor. Can. J. Bot., 57, 120-136.
Zažímalová E. et al., 2007. Polar transport of the plant hormone auxin – the role of PIN-FORMED (PIN) proteins. Cell. Mol. Life Sci., 64, 1621-1637.
