Opportunités pour la valorisation des végétaux riches en anthocyanes comme sources de colorants alimentaires (synthèse bibliographique)
Reçu le 2 mars 2015, accepté le 6 octobre 2015
Résumé
Introduction. Très répandues dans le règne végétal, les anthocyanes sont le sujet d'un grand nombre d'études qui abordent en général les aspects concernant leur instabilité vis-à-vis des conditions dans lesquelles elles sont employées ou l'effet bénéfique de leur consommation sur la santé.
Littérature. Ces aspects sont particulièrement importants lorsqu’on envisage de les extraire en vue de leur utilisation comme colorant alimentaire naturel. Dans cette revue bibliographique, les propriétés des anthocyanes susceptibles d’être altérées lors de leur transformation ont été étudiées. Par la suite, un état des lieux sur les méthodes de fabrication de colorants à base d'anthocyanes a été fait afin de dégager des perspectives pour l'exploitation des matières végétales qui en contiennent de grandes quantités.
Conclusions. Les fruits et légumes utilisables pour la fabrication de colorants alimentaires sont nombreux et variés. Les différences au niveau du contenu ont une influence sur la stabilité de la couleur des extraits, mais les progrès récents en matière de formulation ouvrent des perspectives pour la valorisation des végétaux riches en anthocyanes.
Abstract
Opportunities for the exploitation of plants with a high anthocyanin content as food colorants. A review
Introduction. Widespread in the plant kingdom, anthocyanins are the subject of a large number of studies related mainly to their instability in the conditions in which they are used, along with the beneficial effect of their consumption on diseases caused by the accumulation of free radicals.
Literature. These aspects are particularly important since anthocyanins are extracted from fruits and vegetables for their use as natural food colorants. This literature review will focus on properties that might be damaged during extraction and purification of anthocyanins. The procedures for the extraction of anthocyanins were reviewed in order to identify opportunities for the use of plant materials in which these molecules are present in large amounts.
Conclusions. The color and stability of anthocyanin extracts from fruits and vegetables are strongly influenced by their composition. However, recent improvements in food colorant formulation methods offer new opportunities for the exploitation of vegetables with a high anthocyanin content.
1. Introduction
1Les anthocyanes sont des métabolites secondaires des végétaux généralement localisés dans les vacuoles. Leur couleur vive attire les insectes et les oiseaux qui jouent un rôle majeur dans la pollinisation des fleurs et la dispersion des graines. Les principaux rôles physiologiques qui leur sont attribués dans la plante sont, entre autres, l'absorption des radiations néfastes pour la chlorophylle b, le transport des monosaccharides, la régulation de la pression osmotique durant les périodes de sècheresse et de froid ou la régulation de la réponse antioxydative des plantes soumises à des facteurs de stress (Kovinich et al., 2014).
2Elles sont particulièrement étudiées pour leur problème de stabilité notoire, l'effet positif de leur consommation sur la santé et leur potentiel en tant que colorant alimentaire naturel. Ce sont ces domaines qui seront abordés dans la revue bibliographique qui suit dans le but de faire le point sur l'exploitation des fruits et légumes riches en anthocyanes comme sources de colorants alimentaires.
3Les documents utilisés proviennent, pour l’essentiel, de la base de données Scopus et des outils qui permettent d’affiner les recherches documentaires (articles similaires, articles citant ou ayant été cités par). D’autres part, cette revue comporte des aspects qui concernent des procédés brevetés, d’où la consultation de bases de données telles que le site web de l’USPTO (United States Patents and Trademark Office) et Google Patents.
2. Littérature
2.1. Principales caractéristiques des anthocyanes
4Classées parmi les flavonoïdes, les anthocyanes sont caractérisées par le squelette C6-C3-C6 (Figure 1). Ce sont des glucosides formés de l'association d'un aglycone appelé anthocyanidine et d'un sucre substitué en position 3. Ces sucres qui sont de type mono-, di- ou tri-saccharides peuvent être acylés par des acides aliphatiques (acide malonique, succinique, etc.) ou aromatiques (acide coumarique, ferulique, sinapique, etc.).
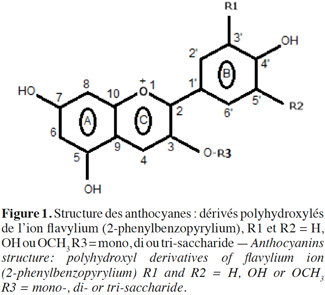
5Les anthocyanidines, dérivés polyhydroxylés de l'ion flavylium (2-phenylbenzopyrylium), se différencient par le nombre et l’emplacement des groupements hydroxyles et méthoxyles. Bien que 31 anthocyanidines aient été identifiés jusqu'à présent, 90 % des anthocyanes sont dérivés de 6 anthocyanidines (Tableau 1). De nombreuses combinaisons sont ainsi possibles et près de 600 composés ont été dénombrés (Andersen et al., 2006).
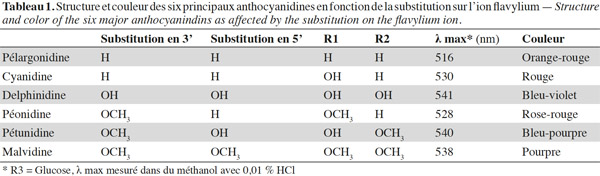
6La couleur des anthocyanes. Leur caractéristique la plus notable est le changement de couleur qu'accompagnent les variations de pH de leur milieu. Lorsque le pH augmente, des changements de structure résultant de réactions d'hydratation et de transfert de protons entrainent des changements de structure et de couleur (Figure 2). De ce fait, pour un même type d’anthocyane, plusieurs formes et structures résonnantes peuvent coexister dans un milieu complexe. Cela s'explique par la conjugaison de l'ensemble des liaisons π des anneaux A et C (Heim et al., 2002).
7Ces changements de couleur entrainent la limitation de leur utilisation comme colorant alimentaire rouge aux denrées ayant un pH inférieur à 5, en outre elles sont particulièrement sensibles aux traitements que ces denrées pourraient subir par la suite.
8Dégradation des anthocyanes. Dans certaines conditions de pH et température, les anthocyanes se dégradent en présence d'oxygène, d'ions métalliques, d'enzymes et de lumière. Cette dégradation est accompagnée d'une augmentation de la concentration de composés formés par la condensation entre les produits de dégradation des anthocyanes et d'autres polyphénols présents dans le milieu. Il s’ensuit une formation de polymères qui, avec le temps, deviennent plus volumineux et tendent à précipiter (Ribéreau-Gayon et al., 1983).
9Effet de l’acidité du milieu. Elle a un effet sur la couleur, mais également sur la réactivité des anthocyanes. L’augmentation du pH a pour effet l’ouverture de l’anneau C par une attaque nucléophile donnant la forme hémiacétale dont la réactivité est supérieure à celle de l’ion flavylium. Dans un milieu fortement acide (pH < 2), les anthocyanes montrent une bonne stabilité vis-à-vis de la température et de l'oxygène. En revanche, dans les mêmes conditions de température et d'aération, leur dégradation s'accélère quand le pH augmente (Torskangerpoll et al., 2005).
10Effet de la température. Les anthocyanes sont thermolabiles et se dégradent à une vitesse qui augmente considérablement avec la température (Aurelio et al., 2008). Elles sont cependant relativement stables pour des températures inférieures à 70 °C. La thermodégradation à 95 °C et pH = 1 commence au bout de 4 h par une déglycosilation suivie d'un clivage conduisant à la libération des anneaux A et B de l'anthocyanidine (Sadilova et al., 2006 ; Patras et al., 2010). Le stockage des anthocyanes à des températures basses permet une très bonne conservation de leur couleur (Verbeyst et al., 2012).
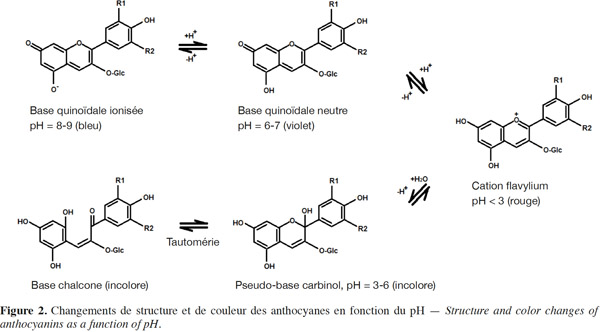
11Effet de la composition du milieu. La présence d’oxygène entraine une dégradation des anthocyanes par un mécanisme qui peut être une oxydation chimique ou une réaction enzymatique en présence de polyphénol oxydase (PPO) (Kader et al., 1999). La PPO est une enzyme endogène responsable du phénomène de brunissement des fruits. Elle oxyde les polyphénols en quinones, lesquels s'associent aux anthocyanes pour former des composés bruns selon le mécanisme schématisé dans la figure 3 (Li H. et al., 2008). Un traitement thermique à 50 °C permet de réduire significativement l'effet de cette enzyme (Patras et al., 2010).
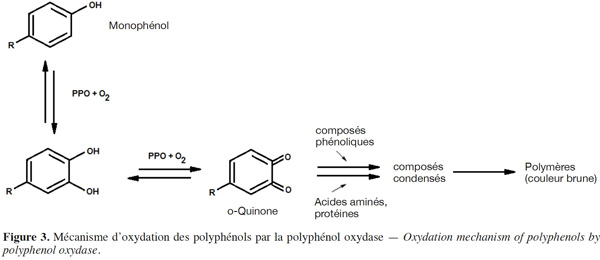
12L’oxydation chimique se fait également par l’intermédiaire de quinones, composés instables dont la formation est catalysée par des ions métalliques (Figure 4). La formation de ces quinones est favorisée pour les polyphénols ayant un groupement ortho-dihydroxybenzene (Li H. et al., 2008 ; Oliveira et al., 2011).
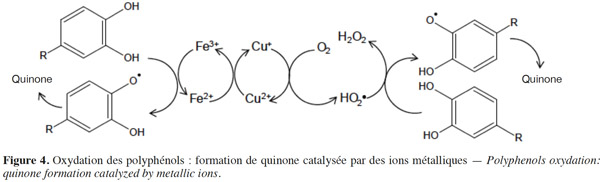
13La dégradation des anthocyanes par l'acide ascorbique se fait par l'intermédiaire des produits de dégradation de ce dernier. En présence d’oxygène, l’oxydation de l’acide ascorbique (oxydoréduction) entraine la formation d’acide désoxy-ascorbique et de peroxyde d'hydrogène qui sont impliqués dans le processus de dégradation des anthocyanes (Krifi et al., 2000 ; West et al., 2013). Le dioxyde de soufre renforce l’action antioxydante de l’acide ascorbique en atténuant (scavenging) le pouvoir oxydant des produits de dégradation de l’acide ascorbique.
14Dégradation enzymatique. Un des phénomènes de dégradation des anthocyanes met en jeu des glycosidases d'origine microbienne. Elle entraine la production d'anthocyanidines caractérisés par une très grande instabilité pouvant donner naissance à des dérivés de l'acide hydroxybenzoïque sous l'action combinée de la chaleur et de l'oxygène. L'acylation a pour effet de prévenir cette dégradation, car les glycosidases d'origine microbienne ne peuvent pas dégrader les glycosides acylés (Yonekura-Sakakibara et al., 2009).
15Stabilisation des anthocyanes
16Copigmentation. Outre la couleur, les différences de structures entrainent une réactivité différente chez les anthocyanes, d’où une stabilité majeure que l’on observe généralement chez les anthocyanes plus complexes. Les substitutions influent sur la stabilité des anthocyanes essentiellement par un phénomène appelé copigmentation. Il a lieu lorsque les substituants d’une anthocyane acylée ou des molécules présentes dans le milieu contribuent à produire un environnement hydrophobe protecteur autour du noyau flavylium (Redus et al., 1999). Cet effet devient significatif seulement lorsqu’il y a une surabondance des molécules protectrices par rapport aux molécules d’anthocyanes (Malien-Aubert et al., 2001).
17Effet de l’activité de l’eau. La diminution de l’activité de l’eau exerce un effet stabilisateur. La stabilité des anthocyanes est généralement bonne dans des produits secs ou à forte teneur en sucres, tels que les sirops et les confitures. La présence de sucre diminue la disponibilité de l'eau, dont la présence est nécessaire à la dégradation des anthocyanes (Tsai et al., 2004).
2.2. Les anthocyanes dans l’alimentation humaine : absorption et biodisponibilité
18Les anthocyanes sont naturellement présentes dans un grand nombre d'aliments consommés régulièrement, notamment les fruits rouges. Les quantités moyennement consommées varient en fonction des pays et des habitudes alimentaires (Manach et al., 2004 ; Wu et al., 2006). Ils sont étudiés pour les effets positifs de leur consommation sur la santé. Ces effets sont généralement attribués à leur pouvoir antioxydant qui leur permettrait de protéger les tissus contre les dégâts causés par les radicaux libres. Ils peuvent ainsi avoir un effet préventif en réduisant les dommages que pourrait provoquer l’accumulation de radicaux libres. On associe leur consommation à l'amélioration de l'acuité visuelle, on leur reconnait des propriétés anticancérigènes, anti-inflammatoires et la capacité de réduire les risques d’être atteints par des maladies cardiovasculaires (Tsuda, 2012 ; Pojer et al., 2013).
19En contraste avec les propriétés qu’on leur reconnaissait, les anthocyanes ont longtemps été considérées comme faiblement biodisponibles. En effet, les quantités retrouvées sont faibles, aussi bien dans le sang que dans les urines, proportionnellement aux quantités ingérées. On considérait en revanche qu’ils pouvaient avoir un effet local en participant à la protection des muqueuses gastro-intestinales contre les effets des radicaux libres. Ils retardaient de ce fait la survenue de maladies qui y étaient associées, telles que les cancers de l’estomac ou du côlon (Gee et al., 2001 ; Prior, 2003). Cependant, les études les plus récentes suggèrent qu’ils ne sont que faiblement absorbés sous leur forme d’origine dans l’estomac et dans l’intestin grêle. On n’en retrouve donc que de faibles quantités dans le sang. Par contre, les métabolites résultant de l’assimilation des anthocyanes se retrouvent dans les urines en quantités proportionnelles aux quantités ingérées (Pérez-Jiménez et al., 2010 ; Czank et al., 2013). Ils sont donc métabolisés par des enzymes dans l’intestin grêle et par la flore bactérienne du gros intestin, donnant des acides phénoliques et autres métabolites plus facilement assimilables par le système circulatoire (Lin et al., 2011 ; Bohn, 2014). Ils modifieraient par ailleurs l’écologie du gros intestin, favorisant les bactéries à effets probiotiques (Del Rio et al., 2010 ; Gasperotti et al., 2014).
20La relation entre la consommation de produits riches en polyphénols et le risque de survenue de maladies est régulièrement, mais jamais définitivement remise en cause (Wang et al., 2012 ; Aziz et al., 2013). En fait, ce sont les méthodes qui permettent d’arriver à ces conclusions ainsi que les modes d’action proposés qui sont remis en question. Opportunément, de nouvelles techniques permettant de tenir compte de la complexité de la relation entre les molécules bioactives et les métabolites générés lors de leur assimilation par l’organisme sont maintenant étudiées et devraient permettre d’avoir une meilleure compréhension des mécanismes (Van Dokkum et al., 2008 ; Manach et al., 2009).
2.3. Les anthocyanes comme colorants alimentaires
21Un colorant alimentaire doit avoir des caractéristiques telles qu’un pouvoir colorant élevé, une grande stabilité dans des conditions spécifiques d’utilisation (pH, température), une gamme de couleurs précise et stable d’un batch de production à l’autre. Les colorants de synthèse possèdent toutes ces caractéristiques, mais leur mauvaise réputation auprès du grand public et les réserves des instances chargées de la règlementation, notamment sur l'hyperactivité des enfants provoquée par les colorants artificiels (les monoazoïques sulfonés) (McCann et al., 2007), poussent les industriels à chercher des alternatives que sont les colorants naturels. Les anthocyanes représentent une des alternatives pour ce qui concerne les colorants de la gamme de couleurs allant du rouge clair au pourpre.
22Aspects règlementaires. La législation européenne sur les additifs se base sur le principe des « listes positives » selon lequel un additif ne peut être utilisé que s'il figure sur une liste de substances autorisées. Elle ne fait pas de distinction entre colorant de synthèse et colorant naturel, bien que les consommateurs la fassent, considérant a priori que les colorants de synthèse sont dangereux. En réalité, les substances autorisées le sont généralement en fonction d'une dose journalière admissible (DJA) par kilogramme de poids corporel et leur utilisation doit être limitée à la dose minimale nécessaire pour atteindre l’effet désiré (CE, 1994).
23La règlementation des États-Unis en revanche fait une distinction entre les colorants devant faire l'objet d'une certification et les colorants exemptés de certification. Cela se réfère aux procédures précédant la commercialisation : chaque lot de colorant « artificiel » doit être soumis à un contrôle de conformité de la Food and Drug Administration (FDA), préalablement à sa mise sur le marché. Il existe une liste de colorants exemptés de certification (naturels) (Hallagan et al., 1995). On dénombre actuellement 350 additifs autorisés, dont 45 colorants. La FDA a certifié près de 6 000 t de colorants alimentaires durant l'année 2001.
24Pour ce qui concerne l’origine des colorants anthocyaniques, le comité mixte FAO/OMS (Codex Alimentarius) précise que les colorants anthocyaniques rouges (n°163 dans le Système International de Numérotation) doivent être des extraits de marc de raisin, de cassis, de maïs pourpre ou de chou rouge. En revanche, le réglement de l’Union européenne ne fait aucune précision quant à l’origine des colorants à base d’anthocyanes qui doivent être extraites de fruits et légumes comestibles. Les anthocyanes peuvent être utilisées « quantum satis », ce qui signifie qu’aucune limite numérique maximale n’est fixée et que les substances doivent être employées conformément aux bonnes pratiques de fabrication (CE, 2012). Cependant, l’Autorité Européenne de Sécurité Alimentaire (EFSA), dans un avis datant de 2013, relatif notamment à la DJA, recommande de préciser l’origine des anthocyanes, compte tenu du fait que la majorité des données toxicologiques sur la consommation d’extraits aqueux d’anthocyanes se réfèrent au raisin et au cassis. Pour les autres sources d’anthocyanes, l’innocuité doit être prouvée (EFSA, 2013).
25La règlementation américaine distingue quatre catégories de colorants alimentaires parmi ceux qui sont exemptés de certification : « grape color extracts » fabriqués à partir des lies (résidus se déposant dans les récipients contenant du vin après la fermentation), « grape skin extracts » préparés à partir du marc de raisin (résidu de pressurage des raisins), « fruit juices » préparés à partir de fruits comestibles, « vegetable juices » fabriqués à partir de légumes comestibles.
26Les sources d’anthocyanes. Les colorants alimentaires naturels à base d’anthocyanes sont extraits pour l’essentiel des résidus de l’industrie de vinification qui doivent être éliminés dans le respect de la règlementation environnementale européenne. Ce sont des résidus solides (marcs de raisin) constitués des pellicules, des pépins, de rafles et de pulpe et des lies de vin (résidus liquides qui se déposent dans le fond des cuves de fermentation).
27On trouve les anthocyanes chez la plupart des espèces végétales, dans les fruits, les fleurs, feuilles et les organes de réserve. Conformément à la règlementation, les espèces végétales qui sont comestibles peuvent être utilisées pour la fabrication de colorants. Les caractéristiques et les concentrations en anthocyanes de celles qui sont déjà utilisées comme matière première pour la fabrication de colorants alimentaires sont décrites ci-dessous. Elles ont chacune leur particularité pour ce qui concerne leur contenu en anthocyanes et les propriétés des colorants que l’on peut en extraire.
28Le raisin (Vitis vinifera L.) contient des anthocyanes dérivées de chacun des six principaux anthocyanidines. Généralement, ce sont des monoglucosides non acylés, mais il existe également des anthocyanes acylées chez certaines variétés. L’anthocyane majoritaire est souvent la malvidine-3O-Glucoside et les proportions varient de 90 % à parfois moins de 50 % selon les variétés (Flamini et al., 2013).
29Le cassis (Ribes nigrum L.) contient quatre anthocyanes majeures toutes non acylées qui quantitativement représentent 97 % des anthocyanes (jusqu’à 15 types selon les auteurs). Leur concentration totale est de l’ordre de 13 mg·g-1 poids sec (Bordonaba et al., 2011).
30Le maïs pourpre (Zea mays L.) peut contenir jusqu’à 14 mg·g-1 poids sec d’anthocyanes dont 35,6-54,0 % sont acylées (Jing et al., 2007). Les enveloppes des grains de maïs pourpre en contiennent 17-18 % de leur poids sec (Li C.Y. et al., 2008).
31Le chou rouge (Brassica oleracea L.) contient plus de 20 anthocyanes différentes selon les auteurs et les variétés dont les 8 les plus abondantes (tous dérivés mono ou diacylés de la cyanidine) représentent 90 % du total. Leur concentration est de l’ordre de 12,0 mg·g-1 de poids sec (Wiczkowski et al., 2014).
32La patate douce à chaire pourpre (Ipomoea batatas L.) peut contenir, selon les variétés, jusqu’à 6,5 mg·g-1 poids sec. Un total de 17 anthocyanes a été répertorié dans les nombreuses variétés existantes dont 5-7 majeures selon les auteurs, la plupart étant acylées (Truong et al., 2012).
33La carotte noire (Daucus carota L.) contient essentiellement des anthocyanes acylées dont le nombre varie en fonction des auteurs et des variétés. Les extraits de carotte noire sont réputés être plus stables que les extraits d’autres végétaux (Algarra et al., 2014).
34Les procédés de fabrication. En général, les anthocyanes sont extraites avec de l’eau acidifiée tout en évitant les pH qui pourraient les dégrader. On utilise des acides faibles peu corrosifs, tels que des acides organiques à des concentrations qui permettent d’éviter l’hydrolyse des groupements acyles. L’utilisation du bisulfite de sodium est aussi assez fréquente, car elle permet d’améliorer l’extraction de la matière sèche soluble et donc d’augmenter les rendements d’extraction (Cacace et al., 2002).
35Les méthodes d’extractions ne sont généralement pas spécifiques et les extraits obtenus sont un mélange de toutes les substances solubles dans ces conditions. Certaines de ces molécules peuvent amener un gout indésirable, un trouble (protéines, polysaccharides solubles, etc.) ou constituer une interférence pour la méthode de purification envisagée. Les méthodes de purification et de concentration varient donc en fonction de la matière première de départ et des molécules présentes dans l’extrait à purifier.
36Les procédés de fabrication de colorants anthocyaniques se basent sur la démarche qui consiste à éliminer les molécules indésirables. Pour le radis (Raphanus sativus L.), par exemple, la présence de glucosinolates donne un gout spécifique que Jing et al. (2011) ont tenté de réduire par l’utilisation de chitosanes et que Rodriguez-Saona et al. (2001) résolvent par un blanchiment suivi d’une précipitation à basse température. La patate douce contient de l’amidon, des alcaloïdes et des polyphénoloxydases que Wrolstad et al. (2001) éliminent par un ajustement de pH suivi d'une filtration. De nombreuses méthodes alternatives sont régulièrement proposées qui ont l’avantage d’être innovantes, mais qui nécessitent un développement supplémentaire pour être applicables à un niveau industriel (Casazza et al., 2010 ; Pérez-Serradilla et al., 2011 ; Santos et al., 2012).
37La méthode industrielle la plus anciennement utilisée pour la fabrication de colorant à partir de marc de raisin est le procédé SEFCAL (Société d’Études et de Fabrication de Colorants Alimentaires). C’est un procédé à contre-courant qui utilise de l'eau à 80 °C additionnée de 0,2 % de SO2. Il a l'avantage de minimiser les quantités de solvant utilisées. Ainsi, 1 l de solvant est utilisé pour chaque kg de marc de raisin. Après précipitation de l’acide tartrique, fermentation des sucres résiduels, clarification et concentration, ce colorant est vendu sous forme liquide ou en poudre (Bridle et al., 1997). Le procédé a été amélioré par la suite en utilisant les techniques d’ultrafiltration et l’osmose inverse de manière à éliminer l’acide tartrique sans utiliser d’adjuvants et à concentrer sans élever la température (Combe et al., 1978 ; Wallin, 1980 ; Odake, 1990).
38Un procédé appelé Applexion, introduit plus récemment, ayant des applications dans de nombreux domaines, notamment dans la sucrerie, utilise des résines adsorbantes permettant de fixer les polyphénols qui sont ensuite récupérés par désorption avec de l’éthanol (Kammerer et al., 2005).
39Formulation des colorants. En général, des limitations existent quant aux conditions d'emploi de ces colorants, telles que le pH et la température. En effet, les pH d'utilisation sont tout de même limités à 4,5 pour les plus stables, au-delà leur couleur change et ils deviennent bleus, ce qui rend leur utilisation impossible dans des produits comme le yaourt, par exemple. À de tels pH, les anthocyanes se dégradent lorsqu’elles sont soumises à un traitement thermique.
40Les dosages varient d'un type de produit à un autre, tout comme la couleur obtenue et la stabilité des anthocyanes. À titre d'exemple, dans l'industrie de la boisson, le colorant du raisin est utilisé à des dosages de 30 mg·l-1, dans la confiserie le dosage est 0,4 % (w/w), les produits laitiers à un dosage de 0,3-0,5 % (w/w). Leur interaction avec d'autres molécules telles que les protéines, les polyphénols, les polysaccharides, les tannins, de même que le traitement thermique subi par le produit fini doivent être pris en compte pour permettre d'obtenir des résultats satisfaisants d'un point de vue de la couleur et de la stabilité. Par exemple, leur utilisation dans des boissons troubles pourrait entrainer des changements de couleur dus à l'adsorption des anthocyanes sur des particules (Bridle et al., 1997). Du point de vue expérimental, des applications originales telles que l'utilisation dans la mayonnaise, produit riche en matières grasses, ont été envisagées (Li et al., 2014).
41L'adaptation des emballages, la réduction de la date limite de consommation ou la limitation de leur utilisation à certains types de produits représentaient les stratégies adoptées pour permettre leur utilisation. Cependant, les perspectives sont encourageantes vu le nombre de solutions proposées pour résoudre leur problème de stabilité notoire.
42La stabilité au stockage des anthocyanes peut être accrue par la microencapsulation avec de la maltodextrine ou de la cyclodextrine (Mourtzinos et al., 2008). Le dodécylsulfate de sodium (surfactant anionique) a un effet tampon qui permet de maintenir leur couleur jusqu'à pH = 5 (Liu et al., 2014). Un brevet a récemment été déposé grâce auquel les problèmes de stabilité et de biodisponibilité d’extraits d’anthocyanes sont considérablement accrus par l’ajout de cystéine ou plus généralement de composés ayant un groupement –SH (Eidenberger, 2010). Leur capacité à changer de couleur est aussi exploitée pour fabriquer des colorants bleus stables obtenus par chélation des anthocyanes avec du fer (Buchweitz et al., 2013) ou par l'utilisation de mannoprotéines extraites de levures qui permettent d'augmenter de 4 à 5 fois leur stabilité à des températures élevées (126 °C) à pH = 7 (Wu et al., 2015).
3. Conclusions
43Il semble que la plupart des matières premières utilisables comme source de colorants anthocyaniques aient des avantages comparatifs vis-à-vis du marc de raisin. Les anthocyanes acylées réussissent à maintenir leur couleur plus longtemps quand elles subissent une élévation de température prolongée. Le colorant extrait du marc de raisin semble être parmi les moins stables vis-à-vis des conditions du milieu, étant composé presque exclusivement d’anthocyanes non acylées.
44L’avantage du marc de raisin est le fait que c’est un sous-produit d’une industrie fabriquant des produits à haute valeur ajoutée. En 2011, 850 000 t de marcs de raisin et 1,3 million d’hectolitres de lies de vin ont été produits en France. Le colorant alimentaire qui en est extrait n'est pas le seul débouché de ce sous-produit dont on peut extraire de l'eau de vie, des extraits de polyphénols, de l'huile de pépin de raisin, de l'acide tartrique ou que l'on peut utiliser pour l'alimentation animale et les biocarburants de seconde génération voire le compostage. Ces sous-produits de la vinification sont donc une source abondante et bon marché de matière première pour la fabrication de colorants, tandis que les autres matières premières pourraient avoir des couts de production qui réduiraient leur compétitivité. D'autres types de sous-produits sont cependant envisageables comme sources d'anthocyanes tels que les sous-produits du maïs pourpre (rafles et enveloppes des grains) qui contient également des quantités intéressantes d'anthocyanes. Les bractées de bananier, autre sous-produit abondement disponible, sont riches en anthocyanes exploitables comme colorant alimentaire.
45Les matières premières décrites précédemment ont néanmoins le potentiel pour être utilisées comme source de colorants. Elles ont des teintes permettant de couvrir la gamme de couleurs allant du rouge vif de la fraise, au rouge foncé du chou rouge. En outre, les progrès récents en matière de formulation ouvrent de bonnes perspectives pour tous les fruits et légumes ayant des concentrations élevées d'anthocyanes.
Bibliographie
Algarra M. et al., 2014. Anthocyanin profile and antioxidant capacity of black carrots (Daucus carota L. ssp. sativus var. atrorubens Alef.) from Cuevas Bajas, Spain. J. Food Compos. Anal., 33, 71-76.
Andersen Ø.M. & Jordheim M., 2006. The anthocyanins. In: Andersen Ø.M. & Markham K.R., eds. Flavonoids: chemistry, biochemistry and applications. Boca Raton, FL, USA: CRC Press.
Aurelio D.-L., Edgardo R.G. & Navarro-Galindo S., 2008. Thermal kinetic degradation of anthocyanins in a roselle (Hibiscus sabdariffa L. cv. ‘Criollo’) infusion. Int. J. Food Sci. Technol., 43, 322-325.
Aziz Z., Wong S.Y. & Chong N.J., 2013. Effects of Hibiscus sabdariffa L. on serum lipids: a systematic review and meta-analysis. J. Ethnopharmacol., 150, 442-450.
Bohn T., 2014. Dietary factors affecting polyphenol bioavailability. Nutr. Rev., 72, 429-452.
Bordonaba J.G., Crespo P. & Terry L.A., 2011. A new acetonitrile-free mobile phase for HPLC-DAD determination of individual anthocyanins in blackcurrant and strawberry fruits: a comparison and validation study. Food Chem., 129, 1265-1273.
Bridle P. & Timberlake C.F., 1997. Anthocyanins as natural food colours—selected aspects. Food Chem., 58, 103-109.
Buchweitz M., Brauch J., Carle R. & Kammerer D.R., 2013. Colour and stability assessment of blue ferric anthocyanin chelates in liquid pectin-stabilised model systems. Food Chem., 138, 2026-2035.
Cacace J.E. & Mazza G., 2002. Extraction of anthocyanins and other phenolics from black currants with sulfured water. J. Agric. Food Chem., 50, 5939-5946.
Casazza A.A. et al., 2010. Extraction of phenolics from Vitis vinifera wastes using non-conventional techniques. J. Food Eng., 100, 50-55.
CE, 1994. Directive 94/36/CE du Parlement européen et du Conseil, du 30 juin 1994, concernant les colorants destinés à être employés dans les denrées alimentaires. J. Off. Communautés Eur., L 237, 10/09/94.
CE, 2012. Réglement (UE) n°231/2012 de la Commission du 9 mars 2012 établissant les spécifications des additifs alimentaires énumérés aux annexes II et III du réglement (CE) n°1333/2008 du Parlement européen et du Conseil. J. Off. Communautés Eur., L 083, 22.3.2012.
Combe P. & Ladet J., 1978. Process for treatment of anthocyane extracts. United States Patent US 4083779A, 04.11.1978.
Czank C. et al., 2013. Human metabolism and elimination of the anthocyanin, cyanidin-3-glucoside: a 13C-tracer study. Am. J. Clin. Nutr., 97, 995-1003.
Del Rio D., Costa L.G., Lean M.E.J. & Crozier A., 2010. Polyphenols and health: what compounds are involved? Nutr. Metab. Cardiovasc. Dis., 20, 1-6.
Efsa, 2013. Scientific opinion on the re-evaluation of anthocyanins (E 163) as a food additive. Eur. Food Saf. Authority J., 11.
Eidenberger T., 2010. Stabilized anthocyanin compositions. United States Patent US 7820207 B2, 10.26.2010.
Flamini R. et al., 2013. Advanced knowledge of three important classes of grape phenolics: anthocyanins, stilbenes and flavonols. Int. J. Mol. Sci., 14, 19651-19669.
Gasperotti M. et al., 2014. Development of a targeted method for twenty-three metabolites related to polyphenol gut microbial metabolism in biological samples, using SPE and UHPLC–ESI-MS/MS. Talanta, 128, 221-230.
Gee J.M. & Johnson I.T., 2001. Polyphenolic compounds: interactions with the gut and implications for human health. Curr. Med. Chem., 8, 1245-1255.
Hallagan J.B., Allen D.C. & Borzelleca J.F., 1995. The safety and regulatory status of food, drug and cosmetics colour additives exempt from certification. Food Chem. Toxicol., 33, 515-528.
Heim K.E., Tagliaferro A.R. & Bobilya D.J., 2002. Flavonoid antioxidants: chemistry, metabolism and structure-activity relationships. J. Nutr. Biochem., 13, 572-584.
Jing P., Noriega V., Schwartz S.J. & Giusti M.M., 2007. Effects of growing conditions on purple corncob (Zea mays L.) anthocyanins. J. Agric. Food Chem., 55, 8625-8629.
Jing P. et al., 2011. Optimization of purification conditions of radish (Raphanus sativus L.) anthocyanin-rich extracts using chitosan. Lebensm. Wiss. Technol., 44, 2097-2103.
Kader F. et al., 1999. Degradation of cyanidin 3-glucoside by caffeic acid o-quinone. Determination of the stoichiometry and characterization of the degradation products. J. Agric. Food Chem., 47, 4625-4630.
Kammerer D., Gajdos Kljusuric J., Carle R. & Schieber A., 2005. Recovery of anthocyanins from grape pomace extracts (Vitis vinifera L. cv. Cabernet Mitos) using a polymeric adsorber resin. Eur. Food Res. Technol., 220, 431-437.
Kovinich N. et al., 2014. Not all anthocyanins are born equal: distinct patterns induced by stress in Arabidopsis. Planta, 240, 931-940.
Krifi B. & Metche M., 2000. Degradation of anthocyanins from blood orange juices. Int. J. Food Sci. Technol., 35, 275-283.
Li C.Y. et al., 2008. Corn husk as a potential source of anthocyanins. J. Agric. Food Chem., 56, 11413-11416.
Li C.Y. et al., 2014. Antioxidative effect of purple corn extracts during storage of mayonnaise. Food Chem., 152, 592-596.
Li H., Guo A. & Wang H., 2008. Mechanisms of oxidative browning of wine. Food Chem., 108, 1-13.
Lin H.H., Chen J.H. & Wang C.J., 2011. Chemopreventive properties and molecular mechanisms of the bioactive compounds in Hibiscus sabdariffa linne. Curr. Med. Chem., 18, 1245-1254.
Liu S., Fu Y. & Nian S., 2014. Buffering colour fluctuation of purple sweet potato anthocyanins to acidity variation by surfactants. Food Chem., 162, 16-21.
Malien-Aubert C., Dangles O. & Amiot M.J., 2001. Color stability of commercial anthocyanin-based extracts in relation to the phenolic composition. Protective effects by intra- and intermolecular copigmentation. J. Agric. Food Chem., 49, 170-176.
Manach C. et al., 2004. Polyphenols: food sources and bioavailability. Am. J. Clin. Nutr., 79, 727-747.
Manach C., Hubert J., Llorach R. & Scalbert A., 2009. The complex links between dietary phytochemicals and human health deciphered by metabolomics. Mol. Nutr. Food Res., 53, 1303-1315.
Mccann D. et al., 2007. Food additives and hyperactive behaviour in 3-year-old and 8/9-year-old children in the community: a randomised, double-blinded, placebo-controlled trial. Lancet, 370, 1560-1567.
Mourtzinos I. et al., 2008. Thermal stability of anthocyanin extract of Hibiscus sabdariffa L. in the presence of β-cyclodextrin. J. Agric. Food Chem., 56, 10303-10310.
Odake Y., 1990. Method of preparing vegetable or fruit juices. United States Patent US 4925690 A, 05.15.1990.
Oliveira C.M., Ferreira A.C.S., De Freitas V. & Silva A.M.S., 2011. Oxidation mechanisms occurring in wines. Food Res. Int., 44, 1115-1126.
Patras A., Brunton N.P., O'donnell C. & Tiwari B.K., 2010. Effect of thermal processing on anthocyanin stability in foods; mechanisms and kinetics of degradation. Trends Food Sci. Technol., 21, 3-11.
Pérez-Jiménez J. et al., 2010. Urinary metabolites as biomarkers of polyphenol intake in humans: a systematic review. Am. J. Clin. Nutr., 92, 801-809.
Pérez-Serradilla J.A. & Luque De Castro M.D., 2011. Microwave-assisted extraction of phenolic compounds from wine lees and spray-drying of the extract. Food Chem., 124, 1652-1659.
Pojer E., Mattivi F., Johnson D. & Stockley C.S., 2013. The case for anthocyanin consumption to promote human health: a review. Compr. Rev. Food Sci. Food Saf., 12, 483-508.
Prior R.L., 2003. Fruits and vegetables in the prevention of cellular oxidative damage. Am. J. Clin. Nutr., 78, 570S-578S.
Redus M., Baker D.C. & Dougall D.K., 1999. Rate and equilibrium constants for the dehydration and deprotonation reactions of some monoacylated and glycosylated cyanidin derivatives. J. Agric. Food Chem., 47, 3449-3454.
Ribéreau-Gayon P., Pontallier P. & Glories Y., 1983. Some interpretations of colour changes in young red wines during their conservation. J. Sci. Food Agric., 34, 505-516.
Rodriguez-Saona L.E., Giusti M.M., Durst R.W. & Wrolstad R.E., 2001. Development and process optimization of red radish concentrate extract as potential natural red colorant. J. Food Process. Preserv., 25, 165-182.
Sadilova E., Stintzing F.C. & Carle R., 2006. Thermal degradation of acylated and nonacylated anthocyanins. J. Food Sci., 71, C504-C512.
Santos D.T., Veggi P.C. & Meireles M.A.A., 2012. Optimization and economic evaluation of pressurized liquid extraction of phenolic compounds from jabuticaba skins. J. Food Eng., 108, 444-452.
Torskangerpoll K. & Andersen Ø.M., 2005. Colour stability of anthocyanins in aqueous solutions at various pH values. Food Chem., 89, 427-440.
Truong V.D. et al., 2012. Pressurized liquid extraction and quantification of anthocyanins in purple-fleshed sweet potato genotypes. J. Food Comp. Anal., 26, 96-103.
Tsai P.-J., Hsieh Y.-Y. & Huang T.-C., 2004. Effect of sugar on anthocyanin degradation and water mobility in a roselle anthocyanin model system using 17O NMR. J. Agric. Food Chem., 52, 3097-3099.
Tsuda T., 2012. Dietary anthocyanin-rich plants: biochemical basis and recent progress in health benefits studies. Mol. Nutr. Food Res., 56, 159-170.
Van Dokkum W., Frølich W., Saltmarsh M. & Gee J., 2008. The health effects of bioactive plant components in food: results and opinions of the EU COST 926 action. Nutr. Bull., 33, 133-139.
Verbeyst L., Hendrickx M. & Van Loey A., 2012. Characterisation and screening of the process stability of bioactive compounds in red fruit paste and red fruit juice. Eur. Food Res. Technol., 234, 593-605.
Wallin B.K., 1980. Process of purifying plant anthocyanin colors. United States Patent US 4211577 A, 07.08.1980.
Wang Z.-M. et al., 2012. Flavonols intake and the risk of coronary heart disease: a meta-analysis of cohort studies. Atherosclerosis, 222, 270-273.
West M.E. & Mauer L.J., 2013. Color and chemical stability of a variety of anthocyanins and ascorbic acid in solution and powder forms. J. Agric. Food Chem., 61, 4169-4179.
Wiczkowski W., Topolska J. & Honke J., 2014. Anthocyanins profile and antioxidant capacity of red cabbages are influenced by genotype and vegetation period. J. Funct. Food, 7, 201-211.
Wrolstad R.E. & Rodriguez-Saona L.E., 2001. Natural colorant from potato extract. United States Patent US 6180154 B1, 01.30.2001.
Wu J., Guan Y. & Zhong Q., 2015. Yeast mannoproteins improve thermal stability of anthocyanins at pH 7.0. Food Chem., 172, 121-128.
Wu X. et al., 2006. Concentrations of anthocyanins in common foods in the United States and estimation of normal consumption. J. Agric. Food Chem., 54, 4069-4075.
Yonekura-Sakakibara K., Nakayama T., Yamazaki M. & Saito K., 2009. Modification and stabilization of anthocyanins. In: Winefield C., Davies K. & Gould K., eds. Anthocyanins. New York, USA: Springer.
