- Accueil
- Volume 15 (2011)
- numéro 4
- Vitrovariation et régénération par embryogenèse somatique à partir d'embryons mûrs de blé tendre (Triticum aestivum L. var. ‘Nesma' 149) : effet du borate de sodium, de la fragmentation et du scutellum
Visualisation(s): 6233 (42 ULiège)
Téléchargement(s): 309 (4 ULiège)
Vitrovariation et régénération par embryogenèse somatique à partir d'embryons mûrs de blé tendre (Triticum aestivum L. var. ‘Nesma' 149) : effet du borate de sodium, de la fragmentation et du scutellum

Notes de la rédaction
Reçu le 7 juillet 2010, accepté le 2 mars 2011
Résumé
Les effets combinés du borate de sodium, de la fragmentation et du scutellum sur la capacité embryogène d'embryons zygotiques mûrs de blé tendre (Triticum aestivum L. var. ‘Nesma' 149) ont été étudiés. Les caractères morphologiques et le rendement des plantes régénérées diffèrent des plantes témoins et indiquent des variations somaclonales. Les milieux contenant du borax à 0,75 g.l-1 et comportant des explants issus de la fragmentation longitudinale des embryons zygotiques avec scutellum, ont initié des pourcentages élevés de cals embryogènes et de régénération sur une longue période de culture, avec des embryons somatiques de grande taille ainsi qu'une faible variation somaclonale et une nécrose des cals très faible, alors que les milieux contenant moins ou pas de borax et d'explants issus d'embryons zygotiques coupés transversalement et sans scutellum montrent des résultats inverses.
Abstract
Vitrovariation and regeneration by somatic embryogenesis from mature embryos of common wheat (Triticum aestivum L. Var. ‘Nesma' 149): effect of the borate of sodium, the fragmentation and the scutellum. The combined effects of the scutellum, the fragmentation and sodium borate, on the embryogenic capacity of ripe zygotic embryos of common wheat (Triticum aestivum L. var. ‘Nesma’ 149) were studied. The morphological characters and yield of the regenerated plants differ from control plants and indicate somaclonales variations. The mediums containing borax (0.75 g.l-1) and comprising explants resulting from the longitudinal fragmentation of the zygotic embryos with scutellum, initiated high percentages of embryogenic callus and of regeneration over one long period of culture, with large size somatic embryos as well as a weak somaclonale variation and one very low necrosis of callus. Whereas the mediums containing less or no borax and explants resulting from transversely cut zygotic embryos and without scutellum show opposite results.
Table des matières
1. Introduction
1La variabilité des ressources génétiques est un principe majeur de l'amélioration des plantes (Lefort-Buson et al., 1988). En vitroculture, la callogenèse et le repiquage des cultures sont des facteurs qui peuvent induire des variations somaclonales, sources de variabilité (Larkin et al., 1981). Ces variations sont héréditaires (mutations) si elles ont une base génétique (Meins, 1983 ; Maliga, 1984). Pour induire ou/et orienter la vitrovariation, une pression de sélection est exercée par des facteurs de stress, ce qui favoriserait la régénération de plants variants qui peuvent résister à diverses contraintes biotiques ou abiotiques (Zair et al., 2003).
2Chez les céréales, certains anciens travaux ont noté le phénomène de la variation somaclonale (King et al., 1978). D'autres études ont étendu les investigations et ont même réussi à intégrer l'utilisation des variants en amélioration des plantes (Sibi, 1976 ; Sibi, 1981).
3Depuis lors, plusieurs chercheurs ont appliqué ces données à l'amélioration des plantes pour divers caractères morphologiques, physiologiques et de rendement. Ainsi, d'autres céréales ont été étudiées telles que l'orge (Orton, 1980), le riz (Dossou-Yovo et al., 1982) et l'avoine (Mc Coy et al., 1982). D'autres travaux ont confirmé les résultats antérieurs (Vasil, 1987), pour le blé, par exemple le travail de Ryan et al. (1987).
4Chez le blé, l'embryogenèse somatique est généralement induite à partir d'embryons immatures (Li et al., 1992). Dans certaines études, l'addition de quelques extraits a pu améliorer les capacités embryogènes des cultures (Vasil et al., 1982 ; Karim et al., 2005). Dans d'autres travaux, l'ajout d'extraits fongiques au milieu a été utilisé dans le but d'obtenir des plantes résistantes aux agents pathogènes (Ahmed et al., 1991).
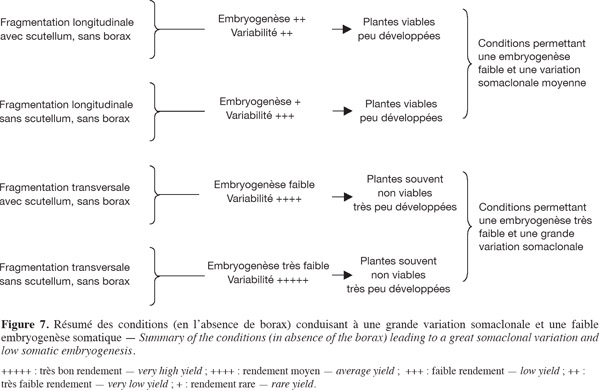
5Nous avons constaté dans des études précédentes l'influence d'un extrait fongique et du borax séparément et combinés sur le rendement en variants de blé (Karim et al., 2005). Le borax pourrait avoir un effet positif sur le rendement en cals en les protégeant de la nécrose et du brunissement. En effet, il a été rapporté que le tampon borate alcalin (pH 6,8-9,1) peut bloquer l'oxydation ; il est largement utilisé comme un inerte électrolyte/pH tampon (Wang, 1996).
6Nous avons également observé dans une autre étude que les embryons mûrs entiers n'étaient pas capables de générer des cals à cause de la germination directe mais après leur fragmentation, la callogenèse et l'embryogenèse se sont améliorées (Chlyah et al., 1990).
7Le présent travail a pour objectif de préciser, dans une première partie, l'effet de la fragmentation et du borax sur l'embryogenèse somatique et la variabilité somaclonale à partir d'embryons mûrs de blé, et dans une deuxième partie, l'effet de trois concentrations du borax sur le rendement en cals embryogènes, embryons somatiques et variations somaclonales.
2. Matériel et méthodes
8Des embryons zygotiques mûrs du blé tendre (Triticum aestivum L. var. ‘Nesma’ 149) ont été utilisés. Les grains de blé sont désinfectés successivement dans l'éthanol (95 °C) pendant 2 min, dans l'hypochlorite de potassium (7 %) pendant 15 min, puis rincés trois fois dans de l'eau distillée stérile. Les grains sont imbibés pendant 16 h dans de l'eau distillée stérile avant le prélèvement des embryons.
9Les embryons sont fragmentés, avec et sans scutellum, de deux manières : section de type T, correspondant à une coupure transversale perpendiculaire au grand axe de l'embryon (Figure 1) et section de type L, correspondant à une coupure longitudinale et perpendiculaire au scutellum (Figure 2).
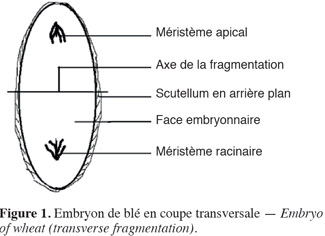
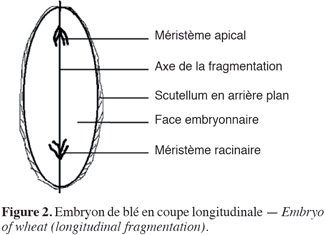
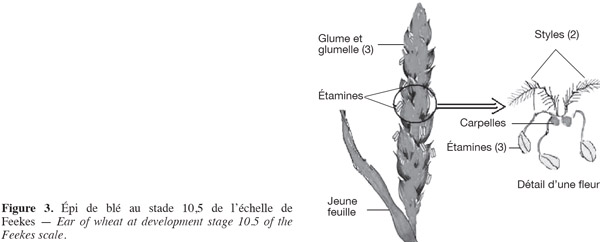
10Le milieu de base (Tableau 1) est celui de Murashige et Skoog (1962), contenant du saccharose (3 %) et de l'agar (1 %). Deux régulateurs de croissance sont ajoutés : le 2,4 D (2,4-Dichlorophénoxyacétique) à 10-6 M et le BA (Benzyladénine) à 10-6 M. Le borax (Tétraborate disodium : Na2B4O7·10H2O) est testé à différentes concentrations (0 ; 0,5 ; 0,75 et 1 g.l-1). Le pH est ajusté à 5,8.
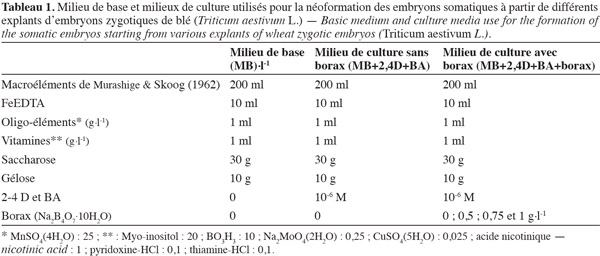
11Chaque embryon est cultivé dans la position axe embryonnaire en contact avec le milieu de culture dans des tubes à essai 16 × 160 mm et placé dans la chambre de croissance sous une photopériode de 16 h et environ 25/22 °C (jour/nuit). Les embryons somatiques se forment après trois à quatre semaines (Hsissou et al., 1994) et commencent sous forme de structures globulaires qui se transforment rapidement en structures bipolaires, pôle racinaire et pôle gemmulaire puis en plantules. Les plantes obtenues sont transférées sous serre et cultivées dans les mêmes conditions que les plantes témoins (après trois mois de culture sur des pots contenant 2/3 de sable fin et 1/3 de terreau) et arrosées régulièrement avec une eau nutritive (eau d'Hogland) jusqu'au stade 10,5 de l'échelle de Feekes (Figure 3) permettant la comparaison des caractères étudiés (Figure 4).
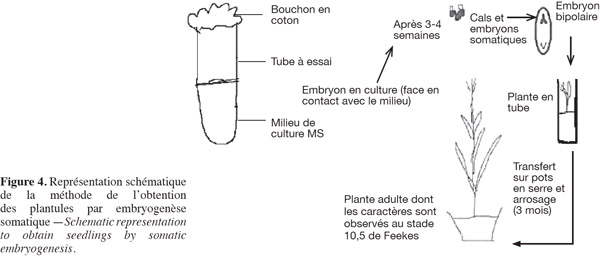
12Les valeurs des tableaux sont des moyennes tirées à partir du comptage de 20 tubes à essai pour chaque caractère. Cependant, tous les caractères sont mesurés et comparés au même stade de développement de la plante en prenant comme référence l'échelle de Feekes comportant 13 stades. Concernant le nombre de cals embryogènes et le pourcentage d'embryogenèse et de régénération, on a compté 30 tubes à essai pour chaque condition de milieu de culture.
3. Résultats
3.1. Caractères morphologiques des plantes témoins
13Les valeurs des différents caractères morphologiques mesurés figurent au tableau 2.

3.2. Variabilité somaclonale au sein des plantes régénérées
14Nous avons suivi dans une étude précédente (Karim et al., 2005) l'aspect et les caractères morphologiques des plantes témoins (cultures dans les pots) du blé, ce qui nous a permis de comparer facilement les plantes normales et les plantes régénérées.
15Afin de créer les conditions favorables à l'apparition des variants, nous avons choisi de mettre les explants sur des milieux favorisant la formation des cals embryogènes d'une part et d'autre part, nous avons mis en jeu l'influence de la fragmentation, c'est-à-dire la réduction des corrélations entre les tissus (Chlyah et al., 1990).
16Comme on le constate, sur base des résultats repris aux tableaux 3 et 4, la longueur la plus grande des tiges est de 47 cm, la plus petite est de 12,3 cm. La longueur des feuilles varie entre 9 et 29,5 cm. Si on observe les résultats des mêmes caractères des plantes témoins (Tableau 2) : 62 cm pour la tige et 31,7 cm pour les feuilles, il parait que c'est au niveau des petites valeurs des caractères que la différence est fortement significative entre les témoins et les autres cultures, alors que pour les plus grandes valeurs, c'est moins significatif. En général, la différence entre les plus petites valeurs obtenues et les plus grandes et les témoins au même stade de développement est très grande et fortement significative.
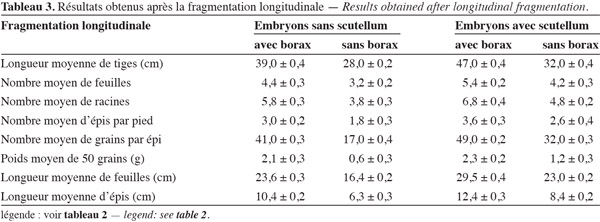
17L'observation des résultats des tableaux 3 et 4 permet également de constater que la plupart des caractères mesurés voient leur valeur changer dans le cas de la fragmentation longitudinale (Figure 2) des embryons avec scutellum et en présence de borax. Pour la longueur des tiges, tous les pieds étaient petits par rapport aux témoins au même stade de développement, la moyenne étant de 47 cm. Le nombre de feuilles ainsi que leur longueur ont sensiblement diminué. Les autres caractères sont restés relativement inchangés. Il en résulte que la section longitudinale avec le borax conduit à une variation somaclonale peu importante, pour tous les caractères mesurés (Tableau 3, colonne embryon avec scutellum plus borax) et donne des individus peu développés mais viables. Cette variation est de moindre importance, comparée à celle obtenue dans un autre travail (Karim et al., 2005).
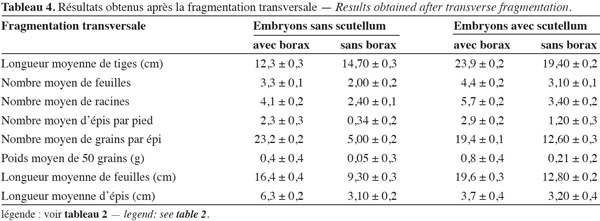
18Par contre, la section transversale (Figure 1) semble donner des individus plus petits encore et très peu développés, le plus souvent non viables : les plus petites plantes ont enregistré une longueur de tige de 12,3 cm, les moyennes étant de 23 cm au même stade de développement. Les feuilles les plus petites ont atteint une longueur de 9 cm, la moyenne étant 19 cm. La présence du borax et de scutellum semble atténuer la variation somaclonale des caractères, c'est dans ce cas qu'on a les valeurs les plus élevées. Dans le cas contraire, c'est-à-dire l'absence du borax et de scutellum, il y a augmentation de la variation (valeurs très faibles). Il en résulte que généralement la section transversale a donné une importante variation somaclonale par rapport à la section longitudinale, avec des individus très peu développés et non viables, surtout lorsqu'il n'y a pas de borax et pas de scutellum.
19D'après les résultats des tableaux 2, 3, 4, 5 et 6, il semblerait que la section longitudinale dans le sens de l'axe de l'embryon est la plus favorable pour stimuler la callogenèse et l'embryogenèse somatique, particulièrement quand le scutellum n'a pas été prélevé, et c'est aussi la plus favorable pour donner moins de variations. Ces résultats confirment ceux obtenus sur l'effet positif de la fragmentation sur les embryons mûrs de blé (Chlyah et al., 1990). On ne peut pas attribuer cette haute fréquence de callogenèse et embryogenèse au scutellum seul, mais également à la probable désorganisation des deux méristèmes gemmulaire et radiculaire par la fragmentation (Figure 5).
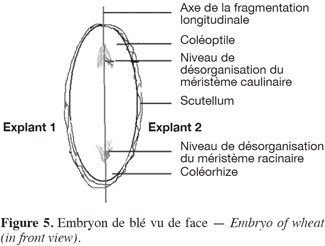
20Il semblerait donc que la variation somaclonale est fortement significative dans le cas de la fragmentation transversale, et la présence du borax et du scutellum dans ce cas serait favorable pour atténuer l'apparition des variants.
3.3. Effet du mode de fragmentation
21Dans le domaine de la culture des embryons, il est généralement admis que la culture des embryons seuls aboutit massivement à une germination directe prédominante avec peu de callogenèse. Nos résultats montrent que plus de 50 % des explants sont concernés par cette germination (Tableau 7).
22Si on prend comme exemple les deux caractères les plus indicateurs du port morphologique de la plante (Tableau 3), à savoir la longueur de la tige et des feuilles, on constate que la différence entre la fragmentation longitudinale et la fragmentation transversale est très significative. Par conséquent, il semblerait que la première serait plus rentable en cals et embryons somatiques et moins en variants. Pour le reste des caractères, les résultats sont moins significatifs comparés aux témoins, mais sont révélateurs de la présence de la variation somaclonale.
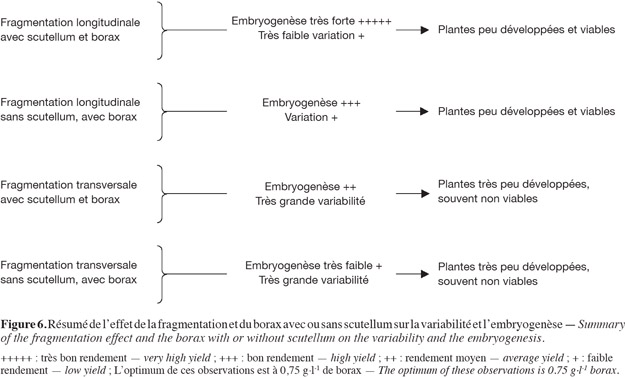
23La fragmentation des embryons a été étudiée par Chlyah et al. (1990) et par Zair et al. (1995), elle constitue un moyen de rendre les explants plus calogènes et embryogènes. Nos résultats vont dans le même sens et montrent que la fragmentation longitudinale donne des explants plus rentables en cals, en embryons somatiques et moins de variations somaclonales (Figures 6 et 7).
24En général, la formation de cals se fait rapidement et les zones de cals compacts et embryogènes ont été observées après 10 à 20 jours. Des embryons somatiques globulaires et allongés entourant des cals sont parfois observés. La plupart de ces embryons germent rapidement sans qu'il y ait repiquage sur un milieu frais, formant des feuilles et des racines, et peuvent être transférés ensuite vers des pots et même dans le sol où ils peuvent se développer.
25Il a été démontré que la fragmentation des embryons peut provoquer et favoriser la formation des embryons somatiques, aussi bien pour les cals embryogéniques que pour les explants. Ainsi, cette fragmentation a fait augmenter le nombre des embryons comparé à la culture des embryons entiers. Dans tous les cas, les embryons immatures sont considérablement plus embryogéniques que les mûrs (Chlyah et al., 1990). Cependant, les embryons mûrs ont montré un potentiel embryogénique particulier après les deux types de fragmentation (Karim et al., 2005).
3.4. Effet du scutellum
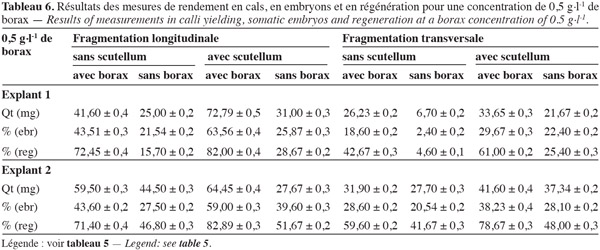
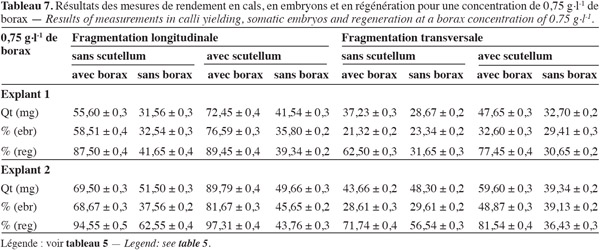
26Le scutellum a été souvent cité dans la littérature comme une partie de l'embryon qui donne des cals et des pousses méristématiques chez le blé (Magnusson et al., 1985) et chez d'autres céréales (Springer et al., 1979 ; Vasil et al., 1982). Nous avons comparé la capacité embryogénique des explants issus des embryons avec ou sans scutellum. Les deux fragmentations n'ont pas donné les mêmes résultats. Ainsi, dans le type longitudinal, plus de 76 % d'embryons somatiques sont produits quand le scutellum n'a pas été prélevé et en présence de 0,75 g.l-1 de borax, le type transversal a donné des résultats opposés. Cependant, dans tous les cas, l'embryogenèse somatique observée a montré que la présence du scutellum n'est pas absolument nécessaire mais souhaitable en présence du borax.
27Dans les deux fragmentations, quand on compare la capacité embryogénique des explants avec et sans scutellum, on constate que les premiers ont produit plus d'embryons somatiques que les derniers, confirmant le fait que le scutellum a un effet positif sur la production des embryons somatiques. Cet effet positif a été aussi observé quand le scutellum n'est pas mis en contact avec le milieu et en présence du borax.
28Les embryons entiers (Tableau 7) avec scutellum et dont l'axe embryonnaire est en contact avec le milieu et en présence du borax, semblent les plus rentables en cals embryogéniques, suivis des embryons sans scutellum puis des embryons avec scutellum en contact avec le milieu. Le premier cas semblerait être avantagé par la position de l'embryon sur le milieu qui met celui-ci en contact direct avec l'axe embryonnaire.
29Dans le cas de Pennisetum, le cal embryogénique est formé uniquement à partir des cellules scutellaires auprès du nœud (Vasil et al., 1982), alors que dans le cas de la culture des embryons entiers de blé, le cal embryogénique a été généralement observé, soit sur le tissu scutellaire, soit à partir de l'épiblaste (revêtement de l'embryon), cela dépend de la position de l'embryon sur le milieu (Mc Coy et al., 1982 ; He et al., 1986).
30Nous avons comparé la capacité embryogénique des explants issus des embryons avec ou sans scutellum. Les deux fragmentations n'ont pas donné les mêmes résultats. Ainsi, dans la fragmentation de type longitudinal (Tableaux 3 et 7), plus de 47 % d'embryons somatiques sont produits quand le scutellum n'a pas été prélevé, la fragmentation de type transversal a donné des résultats opposés (Tableaux 4 et 7). Cependant, dans tous les cas, l'embryogenèse somatique observée montre que la présence du scutellum n'est pas absolument nécessaire. Dans la fragmentation transversale, quand on compare la capacité embryogénique des explants avec et sans scutellum, on constate que les premiers ont produit plus d'embryons somatiques que les derniers, confirmant le fait que le scutellum a un effet positif sur la production des embryons somatiques. Cet effet positif a été aussi observé quand le scutellum n'est pas prélevé avant la formation et la culture des explants (embryons entiers).
3.5. Effet du borax
31Depuis l'utilisation pour la première fois du borax (Karim et al., 2005), nous avons constaté son effet positif sur les cultures : il empêche la formation des nécroses et le brunissement des cals. Il faut préciser que le borax est un minéral qui entre dans la composition de certains engrais et qui est utilisé comme insecticide et antiseptique puissant.
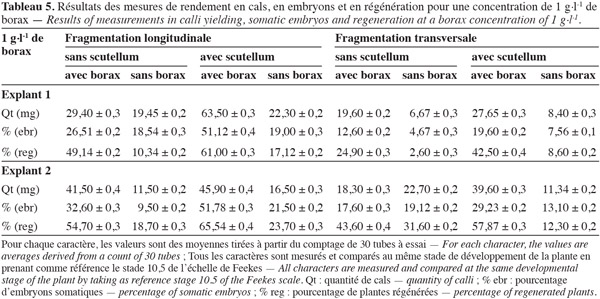
32Nous avons donc maintenu la concentration de 1 g.l-1, utilisée dans le travail précédent (Karim et al., 2005), pour préciser l'effet du borax sur la variation somaclonale et nous avons appliqué deux autres concentrations, 0,5 et 0,75 g.l-1 du borax pour tester leurs effets sur la production de cals et des embryons et leur régénération.
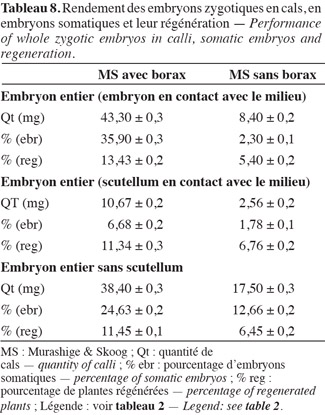
33Les résultats ont montré (Tableaux 5, 6, 7 et 8) que le borax favorise le rendement en embryons somatiques. D'après le comptage du nombre de cals compacts embryogènes et le pourcentage des embryons somatiques réalisés sur les embryons fragmentés, il s'est avéré que dans le cas de présence de borax, les explants ont produit plus de cals et d'embryons somatiques qu'en son absence, ainsi qu'une diminution significative du phénomène de la nécrose des cals et de leur infection. L'optimum de cette production est obtenu avec la concentration 0,75 g.l-1, les valeurs des tableaux 6 et 7 indiquent une nette amélioration des facteurs callogenèse et embryogenèse, respectivement pour les concentrations de borax 0,5 g.l-1 et 0,75 g.l-1, mais la valeur de 1 g.l-1 semble moins rentable que 0,75 g.l-1 qui reste la concentration optimale.
34En comparant les valeurs des deux tableaux 3 et 4, on constate que la fragmentation longitudinale a donné des valeurs supérieures par rapport à la fragmentation transversale, mais ces valeurs sont inférieures à celles du témoin. En présence du borax, la différence est plus significative car les valeurs sont beaucoup plus positives qu'en l'absence du borax (Figures 6 et 7).
35Un autre résultat peut être tiré des tableaux 3 et 4, c'est que toutes les valeurs obtenues dans le cas de la présence du borax sont supérieures aux valeurs sans borax. L'effet positif que pourrait exercer le borax sur la callogenèse et l'embryogenèse a été observé dans un travail précédent (Karim et al., 2005).
3.6. Comparaison entre le pôle racinaire et le pôle gemmulaire de l'embryon
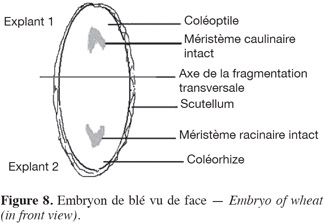
36Dans le cas de la fragmentation transversale (Tableaux 5, 6 et 7), les explants racinaires ont donné trois à cinq fois plus d'embryons somatiques que les explants apicaux. Ce résultat confirme d'une part que la fragmentation transversale préserverait les méristèmes de coléorhize et de coléoptile (Figure 8) qui restent intacts et d'autre part, que le pôle radiculaire est le premier à être activé par l'apparition des initiums radiculaires.
37Ces résultats montrent que les deux pôles de l'embryon, quand ils sont cultivés séparément, peuvent produire des embryons somatiques, particulièrement la zone méristématique racinaire.
38D'autre part, la région radiculaire a montré une capacité embryogénique particulière dans notre étude, contrairement à d'autres études où il a été montré qu'elle est incapable de produire des cals embryogéniques dans tous les cas des cultures d'embryons (Heyser et al., 1985).
3.7. Influence du nombre d'explants par embryon cultivé
39En général, l'augmentation du nombre d'explants par embryon cultivé fait augmenter aussi le nombre total d'embryons somatiques formés. Ceci a été particulièrement vérifié pour la fragmentation longitudinale et transversale puisque le nombre et la quantité ont augmenté par rapport à l'embryon entier. Ces résultats vont dans le même sens que ceux de Chlyah et al. (1990) dans lequel les types B et C de la fragmentation ont fait augmenter le taux des embryons somatiques respectivement de 58 % et 75 %, quand les six explants sont pris plutôt par deux. La réduction de la dimension de chaque explant pourrait augmenter le potentiel embryogénique total de chaque embryon zygotique.
3.8. Durée d'imbibition
40La durée d'imbibition des graines avant le prélèvement des embryons mûrs est de 20 h. Cette durée longue a été choisie car elle était favorable et optimale dans un précédent travail (Chlyah et al., 1990). Dans d'autres études (Ozias-Akins et al., 1983), les embryons mûrs n'ont pas donné de cals embryogéniques, cela pourrait être dû à la trop courte durée d'imbibition des graines.
4. Discussion et conclusion
41Le processus d'embryogenèse somatique qui représente l'une des voies conduisant à des modifications épigénétiques et donc à l'apparition de la variation somaclonale, pourrait être contrôlé et amélioré par divers procédés.
42Dans cette étude, on a déterminé le type de fragmentation qui pourrait améliorer la capacité embryogénique ainsi que la variation somaclonale et observé le rôle du scutellum et du borax dans l'embryogenèse somatique.
43La culture d'embryons entiers s'accompagne d'une callogenèse et embryogenèse faible et la majorité des cultures ne donnent pas de cals et finissent par germer directement. Toutefois, en comparant les cultures, il semblerait que la présence du scutellum, sans qu'il soit en contact avec le milieu et le borax, améliore la callogenèse et l'embryogenèse.
44La germination précoce des embryons cultivés était souvent un problème rapporté par de nombreux auteurs (Vasil et al., 1982 ; Botti et al., 1983). Des recherches intensives ont été orientées vers l'étude des facteurs la minimisant, telles que la nature du milieu de culture et les facteurs d'environnement ainsi que l'âge précis des embryons zygotiques immatures (Lu et al., 1983).
45Aussi, il semblerait que les explants qui ont gardé leur scutellum donnent plus de cals et d'embryons somatiques que les autres, ceci s'explique par l'effet de la cicatrisation causée par la fragmentation du scutellum et le fait qu'il ne soit pas en contact avec le milieu. La cicatrisation causée par la fragmentation induirait une callogenèse plus importante sur le scutellum. Néanmoins, tous les types d'explants obtenus à partir des deux modèles de fragmentation étaient capables de donner des cals et des embryons somatiques, qui rapidement donnent des plantules viables ou non. Il faut aussi souligner que la majorité d'explants cultivés ont formé un nombre moyen total élevé d'embryons somatiques, ce qui permet de dire que les facteurs réunis dans cette étude sont favorables à l'embryogenèse.
46Un autre point a été soulevé dans cette étude, c'est le rôle du scutellum dans l'embryogenèse somatique. Cette partie de l'embryon, quand elle n'est pas en contact avec le milieu de culture, montre une forte initiation de cals embryogéniques. Nous avons trouvé qu'en général, la présence du scutellum favorise souvent l'embryogenèse, mais ce n'est pas le seul tissu embryogénique sur l'embryon, bien que d'autres études ont montré que la culture seule du scutellum n'a pas donné de cal embryogénique (Botti et al., 1983).
47Dans le cas de Pennisetum, le cal embryogénique est formé uniquement à partir des cellules scutellaires auprès du nœud (Vasil et al., 1982). Alors que dans le cas de la culture des embryons entiers de blé, le cal embryogénique a été généralement observé soit sur le tissu scutellaire, soit à partir de l'épiblaste (revêtement de l'embryon), cela dépend de la position de l'embryon sur le milieu (Magnusson et al., 1985 ; He et al., 1986). Les divisions cellulaires dans ces zones, rapidement initiées, peuvent inhiber les divisions dans d'autres zones de l'embryon. Ainsi, nous avons montré que la fragmentation pourrait enlever l'inhibition exercée par corrélation de certaines cellules en division sur les autres qui ne le sont pas. La réduction des corrélations intercellulaires fait augmenter le potentiel des cellules, comme il a été démontré dans d'autres types de cultures telles que celles des couches cellulaires minces (Chlyah, 1984).
48Il a été démontré que la fragmentation des embryons peut provoquer la formation des cals et des embryons somatiques, aussi bien pour les cals embryogéniques que pour les explants. Ainsi, elle a fait augmenter le nombre des embryons comparé à la culture des embryons entiers (Chlyah et al., 1990 ; Zair et al., 1995).
49L'utilisation des explants petits et réduits a procuré un très grand nombre de cellules avec une capacité embryogénique élevée, surtout quand ils ont gardé leur scutellum. En éliminant la germination précoce par la fragmentation des embryons cultivés, on les rend plus efficaces dans l'embryogenèse somatique, spécialement quand ils sont cultivés sur un milieu de culture et dans des conditions d'environnement optimales.
50Les sections longitudinales, particulièrement celles qui passent sur les méristèmes apicaux et racinaires, pourraient désorganiser la fonction originale de ces derniers et permettre ainsi aux embryons somatiques de se développer à partir des cellules simples ou d'un ensemble de cellules pro-embryonnaires, elles-mêmes dérivées d'une seule cellule (Haccius, 1978). Ainsi, nous avons montré que par la fragmentation des embryons entiers, un grand nombre de cellules, dans différentes zones de l'embryon, en particulier le scutellum, deviennent capables d'initier des cals embryogéniques (Chlyah et al., 1990).
51D'après une étude faite sur les embryons de Pennisetum americanum (Botti et al., 1983), la culture de différentes zones de ces embryons a montré que seule la partie apicale et l'axe gemmulaire ont un potentiel embryogénique. De même, seule la partie plumellaire pourrait avoir un potentiel embryogénique important par formation de nouveaux initiums racinaires après fragmentation et culture de différentes parties d'embryons de Dendrophihoe falcata (Bajaj, 1966).
52Dans notre étude, la région radiculaire a montré une capacité embryogénique particulière alors qu'il a été noté dans d'autres études qu'elle est incapable de produire des cals embryogéniques dans tous les cas des cultures d'embryons (Heyser et al., 1985)
53D'autre part, les explants 2 et 1 dans la fragmentation transversale, correspondant respectivement à la partie racinaire et apicale, donnent moins de cals et d'embryons somatiques, cela s'expliquerait par le fait que le centre méristématique racinaire restant intact défavorise la callogenèse et l'embryogenèse. Ce qui n'est pas le cas pour la fragmentation longitudinale qui, du fait que la coupe affectant les centres méristématiques, favorise l'apparition des cals et des embryons somatiques.
54Le borax dans des travaux précédents (Karim et al., 2005) a été utilisé comme facteur toxique pour créer la variation. Malgré les conditions stériles, il s'est avéré que certaines cultures stérilisées au départ deviennent progressivement brunes, se nécrosent et dans la plupart du temps finissent par s'infecter. Ce produit a montré une certaine efficacité dans la prévention des infections opportunes. Il a tendance à atténuer le taux de la variabilité et en même temps améliorer le rendement en cals et en embryons somatiques, qui sont la source des variants.
55La fragmentation longitudinale et la présence du borax ainsi que le scutellum ont montré une nette synergie pour améliorer le rendement en cals embryogènes et en embryons somatiques, une meilleure régénération et peu de variants souvent viables.
56La fragmentation transversale a montré plus de variants par rapport à la fragmentation longitudinale. Cependant, au moins au niveau de la longueur des plantes et des feuilles, et en présence de borax et scutellum, le taux de variation a diminué par rapport aux autres cas. La diminution des valeurs des caractères mesurés est un résultat souvent rencontré par d'autres auteurs. Qureshi et al. (1992) et Cheng et al. (1992) ont trouvé le même résultat pour la grosseur et le nombre des épis.
57L'embryogenèse somatique, qui est une voie prometteuse en particulier chez les céréales, a besoin d'être améliorée incessamment en apportant d'autres éléments originaux au milieu de culture. Le borax a joué un rôle important dans la prévention de la nécrose et le brunissement des cals embryogéniques. Il reste à démontrer comment il agit, est-ce par préservation seulement ou par activation d'autres zones callogènes ? Nos connaissances doivent être améliorées, notamment en ce qui concerne les mécanismes moléculaires impliqués dans les variations somaclonales.
Bibliographie
Ahmed K.Z., Mesterhazy A. & Sagi F., 1991. In vitro techniques for selecting wheat (Triticum aestivum L.) for Fusarium resistance. I: Double-layer culture technique. Euphytica, 57(3), 251-257.
Bajaj Y.P.S., 1966. Behavior of embryo segments of Dendrophthoe falcata (L.F.) Ettings., in vitro. Can. J. Bot., 44, 1127-1131.
Botti C. & Vasil I.K., 1983. Plant regeneration by somatic embryogenesis from parts of cultured matures embryos of Pennisetum americanum L.K. Shum. Z. Pflanzenphysiol., 111, 319-325.
Cheng X.Y. et al., 1992. Somaclonal variation in winter wheat: frequency, occurrence and inheritance. Euphytica, 64(1-2), 1-10.
Chlyah H., 1984. Correlations in organogenesis. In: Proceedings of the international symposium Plant tissue and cell culture application to crop improvement, 1984, Olomouc, Czechoslovakia. Prague: Czechoslovak Academy of Sciences, 57-66.
Chlyah H., Hsaine M., Karim R. & Chlyah A., 1990. Improvement of somatic embryogenesis in wheat by segmentation of cultured embryos. In: Bajaj Y.P.S., ed. Biotechnology in agriculture and forestry. 13. Wheat. Heidelberg, Germany: Springer-Verlag, 88-97.
Dossou-Yovo S., Prioul J.L. & Demarly Y., 1982. Croissance et photosynthèse comparées de phénovariants de riz. Agronomie, 2(5), 493-502.
Haccius B., 1978. Questions of unicellular origin of non-zygotic embryos in callus cultures. Phytomorphology, 28, 74-81.
He D.G., Tanner G. & Scott K.J., 1986. Somatic embryogenesis and morphogenesis in callus derived from the epiblast of immature embryos of wheat (Triticum aestivum L.). Plant Sci., 45(2), 119-124.
Heyser J.W. et al., 1985. Long-term high-frequency plant regeneration and the induction of somatic embryogenesis in callus culture of wheat (Triticum aestivum L.). Z. Pflanzenzuecht., 94(3), 218-233.
Hsissou D. & Bouharmont J., 1994. In vitro selection characterization of drought-tolerant plant of durum white (Triticum durum Desf.). Agronomie, 14(2), 65-70.
Karim R., Chlyah H., Badoc A. & Douira A., 2005. Obtention de pieds néoformés suite à l'induction de cals embryogènes d'embryons zygotiques de blés par le borate de sodium et un extrait de Fusarium graminearum. Bull. Soc. Pharm. Bordeaux, 144(3-4), 195-210.
King P.J., Potrykus V. & Thomas E., 1978. In vitro genetics of cereals: problems and perspectives. Physiol. Veg., 16(3), 381-399.
Larkin P.J. & Scowcroft W.R., 1981. Somaclonal variation - a novel source of variability from cell cultures for plant improvement. Theor. Appl. Genet., 60, 197-214.
Lefort-Buson M., Hebert Y. & Damerval M.P., 1988. Les outils d'évaluation de la diversité génétique. Agronomie, 8(3), 173-178.
Lu C., Vasil V. & Vasil I.K., 1983. Improved efficiency of somatic embryogenesis and plant regeneration in tissue cultures of maize (Zea mays L.). Theor. Appl. Genet., 66, 285-289.
Li Z.Y., Xia G.M., Chen H.M. & Guo G.Q., 1992. Plant regeneration from protoplast derived from embryogenic suspension culture of wheat (Triticum aestivum L.). J. Plant Physiol., 139, 714-718.
Magnusson I. & Bornman C.H., 1985. Anatomical observations on somatic embryogenesis from scutellar tissues of immatures zygotic embryos of Triticum aestivum. Physiol. Plant., 63, 137-145.
Maliga P., 1984. Isolation and characterization of mutants in plant cell culture. Ann. Rev. Plant Physiol., 35, 519-542.
Mc Coy T.J., Phillips R.L. & Riues H.N., 1982. Cytogenetic analysis of plants regenerated from oat (Avena sativa) tissue cultures. Can. J. Genet. Cytol., 28, 299-329.
Meins F., 1983. Heritable variation in plant cell culture. Ann. Rev. Plant Physiol., 34, 327-346.
Orton T.J., 1980. Chromosomal variability in tissue cultures and regenerated plants of Hordeum. Theor. Appl. Gen., 56, 101-112.
Ozias-Akins P. & Vasil I.K., 1983. Improved efficiency and normalization of somatic embryogenesis in Triticum aestivum (wheat). Protoplasma, 117(1), 40-44.
Qureshi J.A., Hucl P. & Kartha K.K., 1992. Is somaclonal variation a reliable tool for spring wheat improvement? Euphytica, 60(3), 221-228.
Ryan S.A., Larkin P.J. & Ellison F.W., 1987. Somaclonal variation in some agronomic and quality characters in wheat. Theor. Appl. Gen., 74, 71-82.
Sibi M., 1976. La notion de programme génétique chez les végétaux supérieurs : obtention des variants par culture de tissus in vitro sur Lactuca sativa L., apparition de vigueur chez les croisements. Ann. Amélior. Plantes, 26(4), 523-547.
Sibi M., 1981. Hérédité des variants épigéniques obtenus par culture de tissus in vitro chez les végétaux supérieurs. Thèse de doctorat : Université de Paris-Sud (France).
Springer W.D., Green C.E. & Kohn K.A., 1979. A histological examination of tissue culture inhibition from immature embryos of maize. Protoplasma, 101, 269-281.
Vasil V. & Vasil I.K., 1982. The ontogeny of somatic embryos of Pennisetum americanum (L.) K. Schum. in cultured immature embryos. Bot. Gaz., 143, 454-465.
Vasil I.K., 1987. Developing cell and tissue culture systems for the improvement of cereal and grasses crops. J. Plant Physiol., 128(3), 193-309.
Wang X.H., 1996. Interfacial electrochemistry of pyrite oxidation and flotation. I: effect of borate on pyrite surface oxidation. J. Colloid Interface Sci., 178(2), 628-637.
Zair I., Chlyah B. & Chlyah H., 1995. Effet de deux extraits biologiques sur l'embryogenèse somatique et sur la rétention des capacités de régénération chez les cals de blé (Triticum aestivum). Can. J. Bot., 73(3), 498-504.
Zair I. et al., 2003. Salt tolerance improvement in some wheat cultivars after application of in vitro selection pressure. Plant Cell Tissue Organ Culture, 73(3), 237-244.
Pour citer cet article
A propos de : Rachid Karim
Université Mohamed V Ibn Battouta. Faculté des Sciences. Département de Biologie. Laboratoire de Physiologie végétale. BP 1014. MA-10000 Rabat (Maroc). E-mail : karim5870@yahoo.fr
A propos de : Hassan Chlyah
Université Mohamed V Ibn Battouta. Faculté des Sciences. Département de Biologie. Laboratoire de Physiologie végétale. BP 1014. MA-10000 Rabat (Maroc).
A propos de : Allal Douira
Université Ibn Tofail. Faculté des Sciences. Laboratoire de Botanique et de Protection des Plantes. BP 133. MA-14000 Kénitra (Maroc).
A propos de : Mohammed Hsaine
Université Mohamed V Ibn Battouta. Faculté des Sciences. Département de Biologie. Laboratoire de Physiologie végétale. BP 1014. MA-10000 Rabat (Maroc).





