- Accueil
- volume 13 (2009)
- numéro 4
- Caractérisation physique, chimique et microbiologique de trois sols acides tropicaux du Rwanda sous jachères naturelles et contraintes à leur productivité
Visualisation(s): 15437 (338 ULiège)
Téléchargement(s): 444 (11 ULiège)
Caractérisation physique, chimique et microbiologique de trois sols acides tropicaux du Rwanda sous jachères naturelles et contraintes à leur productivité

Notes de la rédaction
Reçu le 1er décembre 2006, accepté le 10 juin 2009
Résumé
Trois sols acides de haute altitude (HA), moyenne altitude (MA) et basse altitude (BA) au Rwanda ont été échantillonnés respectivement dans les stations de Gakuta, Tonga et Cyabayaga pour une caractérisation physique, chimique et microbiologique afin de dégager les principales contraintes à leur productivité. Les sols sont fortement acides en HA et MA (pH 4,1 et 4,7) et modérément acides en BA (pH 5,5). Le taux du carbone organique total (Corg) est satisfaisant à Gakuta (4,5 %) mais diminue avec l'altitude. L'azote total (Ntot), le phosphore et la capacité d'échange cationique effective suivent la même tendance, leurs niveaux étant néanmoins faibles. La saturation en cations basiques et la teneur en P-Bray 2 sont faibles en HA et MA et négativement corrélées avec la teneur en Corg. L'ion Al3+ occupe 32 et 18 % du complexe adsorbant à Gakuta et Tonga et est absent à Cyabayaga. Les rapports carbone microbien (Cmic : Corg) et azote microbien (Nmic : Ntot) indiquent un faible taux de minéralisation/immobilisation dans les sols fortement acides et sont positivement corrélés avec le pH. Les valeurs du rapport Cmic : Nmic indiquent une population microbienne dominée par les champignons, ce qui présage une matière organique (OM) de mauvaise qualité. La faible proportion du carbone facilement métabolisable à Gakuta (5 % du Corg) témoigne également de la mauvaise qualité de la MO. L'intensité de la respiration basale est très faible (0,30 à 0,37 µg CO2.h-1.g-1). L'ajout du glucose pour la respiration induite par substrat a considérablement stimulé l'activité métabolique, d'où les faibles valeurs du quotient d'activation respiratoire (QR = 0,4-0,5). Les valeurs obtenues pour l'activité de la déshydrogénase et de la phosphatase acide sont faibles, mais positivement corrélées avec le Corg. Si l'acidité reste la principale contrainte à la productivité des sols des régions de HA et MA, les faibles teneurs en MO et en N constitueraient une limitation en zone de BA si des pratiques culturales appropriées ne sont pas utilisées.
Abstract
Physical, chemical and microbiological characterization of three tropical acidic soils of Rwanda under natural fallows and productivity constraints. Three acidic soils of highland (HL), middle land (ML) and lowland (LL) from Rwanda were sampled respectively in the experimental stations of Gakuta, Tonga and Cyabayaga for a physical, chemical and microbiological characterization in order to determine their productivity constraints. Soils are strongly acidic in the HL and ML (pH 4.1 and 4.7) and moderately acidic in LL (pH 5.5). The rate of total organic carbon (Corg) is acceptable in Gakuta (4.5%), but decreases with altitude. The total nitrogen (Ntot), the phosphorus and the effective cation exchange capacity follow the same trend, their levels remaining nevertheless weak. Base saturation and Bray2-P content are weak in the HL and ML, but also they are negatively correlated with Corg content. The Al3+ ion occupies 32 and 18% of the exchange complex at Gakuta and Tonga, and is non-existent in Cyabayaga soils. Carbon microbial biomass (Cmic : Corg) and nitrogen microbial biomass (Nmic : Ntot) ratios indicate a weak mineralization/immobilization rate in the highly acidic soils, and are positively correlated with soil pH. Cmic : Nmic ratio values obtained indicate a soil microbial population dominated by fungi, which predicts a poor organic matter (OM) quality. The small proportion of the assimilate carbon fraction at Gakuta (5% of Corg) testifies also to the OM poor quality. Basal respiration rate is very low (0.30 - 0.37 µg CO2.h-1.g-1). The addition of glucose for the substrate induced respiration has considerably stimulated the metabolic activity, which results in low values of respiratory activation quotient (QR = 0.4-0.5). Dehydrogenase and acidic phosphatase activities are very low but positively correlated with Corg. The soil acidity remains the principal constraint to land productivity in the HL and ML regions while low soil OM and N contents would constitute a limitation in LL zone if appropriate land management practices are not used.
Table des matières
1. Introduction
1En région tropicale humide, la mise en valeur des terres rencontre des difficultés liées souvent à l'inadéquation des pratiques utilisées par rapport aux caractéristiques des sols. Dans beaucoup de cas, l'absence de prise en compte des contraintes physiques, chimiques et microbiologiques des sols reste préjudiciable à leur exploitation. Pourtant, il est depuis très longtemps connu que certains paramètres des sols jouent un rôle capital dans la gestion de la nutrition végétale et qu'un approvisionnement adéquat en éléments nutritifs dépend de leur optimisation (Troeh et al., 2005). L'acidité par exemple affecte la plupart des paramètres du sol comme la solubilité des éléments métalliques, l'assimilation des éléments minéraux par les plantes, la structure et l'activité des micro-organismes du sol (Brady et al., 2002 ; Kemmit et al., 2006). Pour la plupart des sols de la zone tropicale humide d'altitude, l'acidification et la toxicité aluminique en résultant sont parmi les facteurs principaux limitant la productivité des sols. La quantité et surtout la qualité de la matière organique dans ces sols sont aussi insuffisantes (Scharpenseel, 1987). Normalement, ce sont les systèmes culturaux ou les changements des modes de gestion des terres qui modifient la teneur totale en matière organique dans un sol (Islam et al., 2000 ; Pulleman et al., 2000).
2Les réactions d'échange cationique entre la solution du sol et le complexe adsorbant se réfèrent à deux importants paramètres chimiques des sols, à savoir la capacité d'échange cationique (CEC) et les cations échangeables. La CEC, qui est une expression de charges négatives par unité de masse d'un sol, est l'une des plus importantes caractéristiques du sol. Seules les argiles et la matière organique, par leurs propriétés colloïdales, peuvent développer des charges importantes à leur surface (Brady et al., 2002). Etant donné que, pour un sol donné, la quantité et la qualité des argiles sont dépendantes des conditions naturelles d'altération, c'est surtout l'augmentation ou la diminution de la teneur en matière organique qui influencent la variation de la CEC dans les sols cultivés. Les cations les plus actifs dans les réactions d'échange sont Al3+, Ca2+, Mg2+, K+ et Na+. Leurs niveaux dans un sol reflètent sa qualité nutritionnelle. De nombreux autres éléments essentiels sont assimilables sous des formes anioniques (i.e. N, P, S). Dans les sols, ces éléments se trouvent cependant en grande quantité sous des formes organiques. L'action microbienne constitue la force motrice de la minéralisation et permet à ces éléments de devenir disponibles aux plantes. Il est de ce fait important de savoir, non seulement les teneurs totales en N, P et S dans un sol, mais aussi leurs formes minérales solubles et disponibles pour la croissance des plantes.
3Les indicateurs biologiques de la fertilité des sols actuellement utilisés sont ceux liés à la taille, à la structure et à l'activité de la population microbienne (Schloter et al., 2003). La biomasse microbienne est de plus en plus considérée comme un marqueur écologique (Smith et al., 1990 ; Davet, 1996 ; Franco et al., 2004) et un indicateur utile de l'amélioration ou de la dégradation des sols (Ros et al., 2003 ; Gil-Sotres et al., 2005). Elle est aussi considérée comme une partie de la matière organique du sol (Smith et al., 1990). Les paramètres les plus utilisés pour estimer la biomasse microbienne sont les C et N microbiens (Joergenson, 1995 ; Davet, 1996). La respiration du sol reflète l'activité de la plupart des micro-organismes du sol. D'après Prosser (1997), la respiration est la plus commune et ancienne mesure indirecte de l'activité microbienne globale dans les sols. D'autres activités ne concernent qu'un nombre restreint d'espèces microbiennes particulières (i.e. activités enzymatiques) (Nannipieri et al., 1990).
4Les activités enzymatiques dans les sols sont sensibles aux modifications environnementales et sont de ce fait considérées comme des indicateurs des perturbations naturelles ou anthropiques (Schloter et al., 2003). Les enzymes le plus souvent mises en évidence dans le sol sont celles appartenant aux groupes des oxydoréductases (déshydrogénases, nitrate-réductases, catalases, etc.) et des hydrolases (phosphatases, nucléases, lipases, amylases, cellulases, etc.). Comme pour la biomasse microbienne du sol (Groffman et al., 2001 ; Cookson et al., 2005 ; Shi et al., 2006 ; Pérez-de-Mora et al., 2006) et la respiration du sol (Borken et al., 2002 ; Wang et al., 2003), plusieurs auteurs démontrent que les activités enzymatiques sont positivement corrélées avec la teneur en matière organique (Garcia-Gil et al., 2000 ; Perucci et al., 2000). Cependant, la qualité de cette dernière est aussi importante que la quantité.
5Il existe cependant très peu d'informations sur les indicateurs chimiques, et surtout biologiques, en ce qui concerne les sols acides tropicaux. Au Rwanda en particulier, l'hétérogénéité édaphique et climatique associée au manque de données suffisantes complique davantage la gestion des terres agricoles. Les contraintes à la fertilité des sols cultivés restent encore mal connues dans les principales régions agricoles du pays et les rares informations existantes demeurent assez générales. La présente étude, inscrite dans un vaste projet qui vise la relance de la fertilité des sols acides du Rwanda par la matière organique, a pour objectifs :
6– d'évaluer les caractéristiques physiques, chimiques et microbiologiques actuelles de trois sols acides de haute, moyenne et basse altitudes du Rwanda,
7– de relever les principales contraintes à la productivité de ces sols,
8– de formuler des recommandations relatives à leur amélioration et exploitation durables.
2. Matériel et méthodes
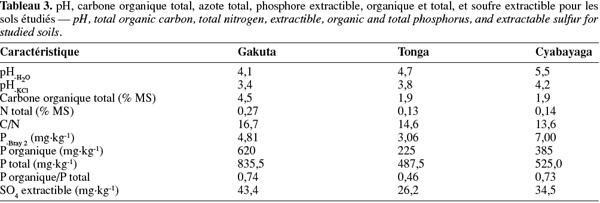
2.1. Choix et description des sites
9Au Rwanda, la diversité des conditions climatiques est à la base de l'importante diversification des cultures. Sur le plan édaphique, les sols sont majoritairement acides (Vander Zaag et al., 1984 ; Beernaert, 1999) et cette acidité croît avec l'altitude (Delpierre, 1974 ; Birasa et al., 1990). L'étude a été conduite sur trois sites représentant les principales régions agricoles du pays, à savoir : la station de Gakuta, zone agricole de la Crête Congo-Nil en région de haute altitude (HA) ; la station de Tonga, zone agricole du Plateau Central en région de moyenne altitude (MA) et la station de Cyabayaga, zone agricole de Savanes de l'Est en région de basse altitude (BA). Le tableau 1 contient les informations sur la localisation, les caractéristiques climatiques et géo-morphopédologiques des trois régions concernées par l'étude.
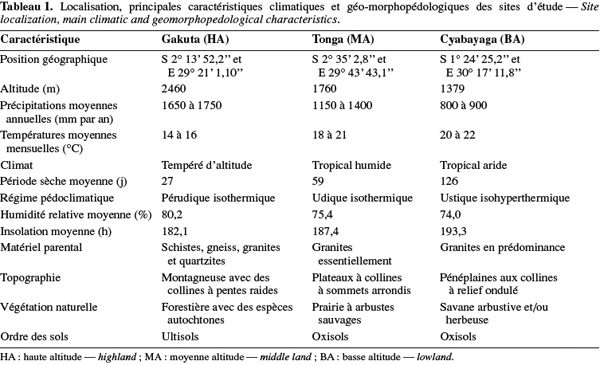
10Le terrain échantillonné à la station de Gakuta (HA) est aménagé en terrasses radicales sous jachère constituées principalement par Vernonia lasiopus O.Hoffm., Vernonia hochstetteri Sch.Bip. ex Walp. et Eragrostis sp. À Tonga (MA), la bande considérée se trouve au pied d'une colline, la jachère dense était constituée essentiellement de Tithonia diversifolia (Hemsl.) A.Gray, Lantana camara L., Acanthus pubescens Thomson ex Oliv. et Digitaria abyssinica (Hochst. ex A.Rich.) Stapf. La parcelle utilisée à Cyabayaga (BA) est une bande aménagée en terrasses progressives, dont les haies anti-érosives sont constituées d'essences agroforestières [Cassia sp., Calliandra calothyrsus Meisn., Sesbania sesban (L.) Merr., Leucaena diversifolia (Schlecht.) Benth., Senna spectabilis (DC.) Irwin & Barneby, etc.] en association avec des graminées. La jachère naturelle était faite de nombreuses espèces de l'ordre des astéracées.
2.2. Prélèvement et préparation des échantillons
11Des échantillons en vrac et des échantillons non perturbés pris dans leur structure naturelle ont été prélevés en septembre 2003. Sur chaque terrain, 10 échantillons élémentaires de surface (0-30 cm) d'environ 500 g chacun et répartis sur deux lignes diagonales ont été prélevés à l'aide d'une sonde appropriée sur une superficie de 12,5 ares. Les prélèvements ont ensuite été mélangés pour constituer un échantillon composite représentatif du terrain. Par ailleurs, sur les mêmes diagonales, six échantillons non perturbés ont été prélevés, à l'aide de cylindres de Kopecky (Blake et al., 1986) et les mesures physiques étaient faites sans trop tarder. Les analyses microbiologiques sur les échantillons en vrac à l'état frais ont été faites à la FUSAGx (devenue ULg Gembloux Agro-Bio Tech) en Belgique, alors que les analyses physiques et chimiques ont été effectuées dans les laboratoires locaux.
2.3. Analyses physiques
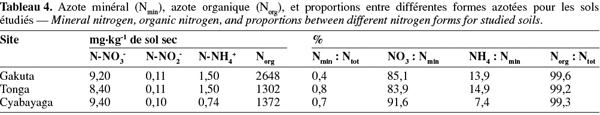
12L'analyse granulométrique a été effectuée sur la terre fine par la méthode densimétrique (Pauwels et al., 1992). La conductivité hydraulique saturée a été déterminée sur les échantillons non perturbés par la méthode de la colonne d'eau constante selon la loi de Darcy (Klute et al., 1986). La densité apparente a été mesurée grâce à la méthode des cylindres en utilisant les échantillons non perturbés (Blake et al., 1986). La capacité maximale de rétention en eau (CREmax) a été estimée par la méthode par percolation suivant la relation :
13CREmax (%) = [WR+WI] x 100/M.S.
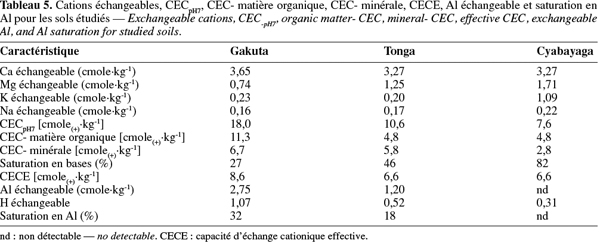
14où WR est la quantité d'eau retenue (g), WI la quantité d'eau se trouvant initialement dans l'échantillon frais (g) et M.S. la matière sèche (g).
2.4. Analyses chimiques
15Tous les paramètres chimiques du sol ont été déterminés suivant les méthodes présentées et détaillées par Pauwels et al. (1992) pour les sols tropicaux et dans la discussion, les résultats obtenus sont principalement comparés aux normes proposées par Landon (1991). Le pH à l'eau et au KCl 1 N a été mesuré par électrométrie dans une suspension sol-solvant (1 : 2,5). Le carbone organique total (Corg) a été dosé selon la méthode par oxydation avec du K2Cr2O7, en présence de H2SO4 concentré. Le N Kjeldahl total (NKT) a été déterminé par la méthode Kjeldahl. La somme [N-NO3 + N-NO2] a été déterminée par la méthode de réduction au zinc en utilisant les réactifs du kit commercial NANOCOLOR®Nitrate Z (Marcherey-Nagel). Le N-NO2 est ensuite mesuré séparément par la méthode à l'acide sulfanilique à l'aide des réactifs du kit Spectroquant® NO2- (Merck). La concentration en N-NO3- est obtenue par la différence. Le N-NH4+ a été mesuré sur les mêmes extraits que les nitrates et les nitrites (extraction au K2SO4 0,5 M). Le dosage est basé sur la réaction des ions NH4+ avec le NaOH en présence de l'hypochlorite (ClO-) grâce aux réactifs du kit commercial Spectroquant® NH4+ (Merck).
16Le P assimilable a été déterminé par spectrophotométrie après extraction avec NH4F 0,03 M et HCl 0,1 M (méthode Bray 2). Le dosage spectrophotométrique du P total a été réalisé après une digestion au HNO3 70 % et HClO4 60-70 % à chaud. Le taux du P organique a été indirectement déterminé en faisant la différence entre le P extractible par le H2SO4 1 N dans un échantillon calciné et non calciné. Les ions SO42- ont été déterminés par gravimétrie à partir des extraits de pâte saturée. Les cations basiques échangeables Na+, K+, Ca++ et Mg++ ont été extraits du sol par une solution de NH4OAc pH 7 1 M. La CECpH7 est déterminée après déplacement des ions NH4+ par du KCl sur le culot de l'échantillon saturé restant après extraction des bases. L'acidité totale a été mesurée par titration avec le NaOH après déplacement des ions H+ et Al3+ par une solution de KCl 1 N. L'ion Al3+ est dosé à part par complexation avec le fluorure. La différence entre les deux titrations correspond au H+ échangeable.
2.5. Analyses microbiologiques
17L'azote de la biomasse microbienne (Nmic) a été mesuré en utilisant la méthode de fumigation-extraction (Joergenson, 1995). Une partie de l'échantillon du sol subit l'extraction au K2SO4 0,5 M immédiatement (solution : sol de 4 : 1), alors que l'autre subit d'abord une fumigation avec du CHCl3 sans éthanol et une incubation pendant 24 h à 20 °C, avant d'être extrait à son tour. L'azote total est analysé dans les extraits et le Nmic est ensuite calculé selon la relation : Nmic = NE/KNE dans laquelle NE = (azote total extractible après fumigation - azote total extractible sans fumigation) et KNE = 0,54 est le facteur de correction. Le carbone facilement métabolisable (Cfm) dans le sol a été déterminé par une mesure de la demande biologique en oxygène (DBO5jours). Les échantillons étaient incubés à 20 °C pendant 5 jours à l'obscurité sous agitation. La nitrification est inhibée par une solution d'allylthiourée (ATU 0,5 mg.l-1) et un inoculum constitué d'une liqueur mixte de boue de station d'épuration (dilution 200 x) était apporté à l'échantillon.
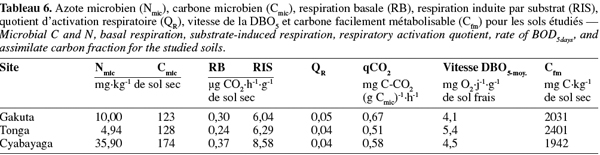
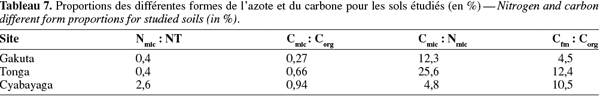
18Le taux de la respiration basale (RB) a été déterminé par incubation de 50 g de sol à 50-60 % de leur CREmax au noir à 20 °C pendant 18 h. La dépression dans le flacon, proportionnelle à la consommation d'O2 par les micro-organismes, était périodiquement enregistrée par des têtes manométriques à infrarouge fermant les flacons. Les données sont ensuite téléchargées et traitées à l'ordinateur à l'aide d'un contrôleur infrarouge (système Oxitop C WTW). La respiration induite par le substrat (RIS) était mesurée sur les mêmes échantillons selon la procédure proposée par la norme ISO 17155:2002 (E). Selon cette méthode, le substrat composé de C6H12O6, (NH4)2SO4 et KH2PO4, est ajouté à la hauteur de 1 % lorsque la teneur en matière organique du sol est < 5 % et l'incubation dure 24 h dans ce cas. Le quotient d'activation respiratoire (QR) a été calculé par le rapport RB : RIS.
19Le carbone de la biomasse microbienne (Cmic) a été estimé par la méthode de RIS (Sparling, 1995 ; ISO, 1997). A partir des données de la RIS, le Cmic est obtenu par la relation : 1 mg O2.100 g-1 de sol sec.h-1 = 28 mg de C microbien.100 g-1 de sol sec. Le quotient métabolique (qCO2) est obtenu par le rapport de la RB sur le Cmic et est exprimé en mg C-CO2.(g Cmic)-1.h-1.
20L'activité enzymatique de la déshydrogénase acide (pH du sol < 6) a été déterminée par la méthode au TTC (Triphenyl Tetrazolium Chloride) (Alef, 1995). La méthode est basée sur l'estimation du taux de réduction du TTC en TPF (TriPhenyl Formazan) dans le sol après incubation à 30 °C pendant 24 h. L'activité de la monophosphoestérase acide (tampon-pH 6,5) a été estimée selon la méthode développée par Alef et al. (1995). Elle est basée sur la lyse du p-nitrophenylphosphate (pNP) par la phosphomonoestérase pour produire du p-nitrophénol après incubation du sol à 37 °C pendant une heure. Le dénombrement de micro-organismes a été réalisé sur un milieu solide courant (PCA).
2.6. Analyse statistique
21Les relations linéaires entre les paramètres physiques, chimiques et microbiologiques choisis deux à deux (n = 9) ont été établies en utilisant les coefficients de corrélation de Pearson grâce au logiciel de traitement statistique Genstat® for Windows, 8e édition (VSN-International Ltd, UK).
3. Résultats et discussion
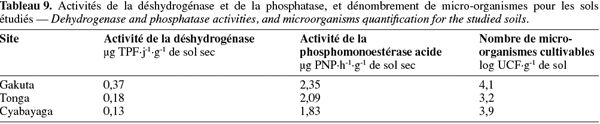
3.1. Caractéristiques physiques
22Le sable est la fraction granulométrique la plus représentative dans la couche arable sur les sites de Gakuta et Cyabayaga (Tableau 2). Quant à Tonga, étant donné que le site se trouve dans une vallée, les sols sont en grande partie argileux. Dans les trois sols, le limon reste la fraction la moins représentée avec moins de 20 % de terre fine (Tableau 2). Selon les limites des classes granulométriques utilisées dans le système USDA/FAO, les sols étudiés entrent dans les classes « argile sableuse » pour Gakuta et Cyabayaga, et « argile » pour Tonga.
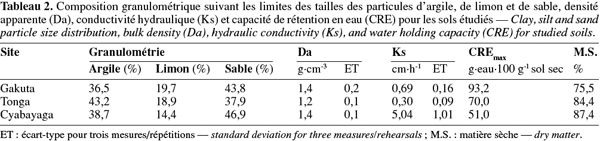
23La densité apparente (Da), la conductivité hydraulique (Ks) et la capacité de rétention en eau (CREmax) sont tributaires de la texture du sol. Les horizons A des sols cultivés ont normalement une Da variant entre 0,9 et 1,8 g.cm-3 (Brady et al., 2002). Les valeurs inférieures à cette gamme caractérisent les couches organiques ou des cendres volcaniques. Les densités apparentes des trois sols étudiés se situent dans la gamme citée (Tableau 2). Bien que la densité apparente, la perméabilité et la capacité de rétention en eau des sols soient en grande partie liées à la texture, les pratiques culturales (les labours mécanisés, les apports ou pertes en matière organique, etc.) influencent aussi énormément la porosité dans les horizons de surface et par voie de conséquence, ces trois propriétés. Compte tenu de sa teneur relativement élevée en argile, le sol de Tonga présente une Da et une Ks faibles par rapport aux sols des deux autres sites (Tableau 2). En revanche, le sol de Gakuta révèle une CREmax plus élevée que ceux de Tonga et de Cyabayaga, malgré sa teneur en argile faible, et cela en raison probablement de sa fraction limoneuse plus élevée et d'une teneur en matière organique de loin plus élevée (Tableau 3). D'après Klute (1986), la matière organique a un effet direct sur la fonction de rétention en eau à cause de sa nature hydrophilique/hydrophobique.
3.2. Caractéristiques chimiques
24Réaction du sol (pH). Les résultats du pH (Tableau 3) montrent que les sols de Gakuta et de Tonga sont fortement acides, alors que celui de Cyabayaga est modérément acide. D'après Brady et al. (2002), il existe très peu de réactions chimiques et microbiologiques dans les sols qui ne soient pas sensibles au pH. A des faibles valeurs de pH, il se produit dans le sol, selon Landon (1991), de nombreux phénomènes néfastes à la croissance végétale comme la diminution de la nitrification, la déficience en phosphore, la toxicité aluminique et manganique, la faible mobilité des polluants organiques et la grande disponibilité de certains métaux lourds. La plupart des plantes cultivées poussent cependant convenablement dans les sols légèrement acides à neutres (5,5 < pH ≤ 7,0).
25Les valeurs moyennes du pH-H2O obtenues dans les sols de Gakuta (4,1) et de Tonga (4,7) sont proches de celles rapportées par Birasa et al. (1990) dans la base de données de la Carte Pédologique du Rwanda (CPR) pour les séries Gisovu et Gako couvrant ces deux stations (pH 4,4 et 4,7). Quant au sol de Cyabayaga, le pH-H2O obtenu (5,5) est d'une unité inférieur à la valeur de 6,6 attribuée à la série Gakirage par Birasa et al. (1990). Nos valeurs moyennes du pH-H2O sont également inférieures à celles attribuées par Vander Zaag et al. (1984) pour les trois zones agricoles concernées (4,9 ; 5,5 et 5,6 respectivement pour la Crête Congo-Nil, le Plateau Central et les Savanes de l'Est).
26Carbone organique total et azote total. Se référant aux normes rapportées par Landon (1991), les sols de Tonga et de Cyabayaga sont peu humifères, alors que la teneur en carbone organique à Gakuta est satisfaisante (Tableau 3). La teneur en carbone organique de 1,9 % obtenue sur ces deux premiers sites, comme d'ailleurs celles caractérisant les séries Gako (Corg = 1,5 %) et Gakirage (Corg = 1,3 %) représentantes de ces stations dans la CPR, indique que la matière organique pourrait constituer un facteur limitant pour la qualité des sols si des systèmes de gestion adéquats ne sont pas adoptés. Comme l'acidité, la teneur en matière organique au Rwanda augmente avec l'altitude (Verdoodt et al., 2003). A des valeurs de pH très faibles (i.e. 4,1 à Gakuta), une bonne partie de la matière organique reste inactive car dans ces conditions, l'activité microbienne se trouve fortement limitée (Kemmit et al., 2006). D'après White (2006), une forte acidité couplée aux températures relativement fraiches comme celles prévalant dans la zone agroclimatique de la Crête Congo-Nil, ralentit la minéralisation. Dans ces conditions, la matière tend à s'accumuler et la production accrue d'acides organiques exacerbe aussi l'acidification des sols. Brady et al. (2002) distinguent les fractions de la matière organique active, lente et passive dans les sols selon la susceptibilité au métabolisme microbien. Rutunga (1997) avait déjà évoqué que les horizons de surface sous Eragrostis dans la région de la Crête Congo-Nil disposaient d'une teneur élevée en matière organique (Corg > 5 %), mais que cette dernière était peu utile parce qu'elle forme, avec le fer et l'aluminium, des composés stables et inactifs.
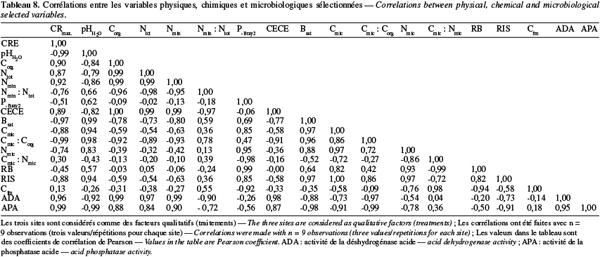
27Les teneurs en azote total sont acceptables pour les trois sites (Tableau 3). Landon (1991) considère les teneurs supérieures à 0,13 % comme satisfaisantes dans les sols tropicaux. La concentration en azote total dans le sol de Gakuta (0,27 %) est deux fois plus élevée que celles obtenues à Tonga (0,13 %) et à Cyabayaga (0,14 %), suite probablement à la matière organique aussi élevée dans cette région. Les teneurs actuelles trouvées à Tonga et à Cyabayaga sont inférieures aux valeurs moyennes attribuées par Vander Zaag et al. (1984) aux régions agricoles du Plateau Central et des Savanes de l'Est. Le rapport Nmin : Ntot qui constitue un bon indicateur du taux de minéralisation est néanmoins plus bas à Gakuta (Tableau 4), confirmant la faible activité biologique de ce sol. Considérant les trois régions de l'étude, ce rapport est positivement corrélé avec le pH (r = 0,66 ; Tableau 8). Tenant compte des valeurs de la densité apparente et du Ntot obtenues pour chaque site, ainsi qu'une tranche de sol de 0-15 cm de profondeur, le site de Gakuta contient 4 961 kg N.ha-1 contre 1 975 kg N.ha-1 à Tonga et 2 570 kg N.ha-1 à Cyabayaga. Afin d'assurer au mieux les besoins de croissance des plantes, Troeh et al. (2005) estiment qu'un sol devrait avoir une quantité d'azote organique d'environ 3 300 kg N.ha-1.
28Phosphore et soufre. Les valeurs du P-Bray 2 obtenues pour les trois sites étudiés sont faibles (Tableau 3), ce qui présage une déficience en P. Cette déficience est plus sévère à Tonga et à Gakuta. Les teneurs en P disponible inférieures à 20 mg P2O5.kg-1 de sol sont considérées comme trop faibles pour assurer une nutrition phosphatée appropriée de la plupart des plantes. Drechsel et al. (1996) avaient signalé des carences en P très préoccupantes dans les régions de la Crête Congo Nil (P-Bray 1 < 2 mg.kg-1) et du Plateau Central (P-Bray 1 < 6 mg.kg-1) à cause du pouvoir fixateur élevé des sols. Troeh et al. (2005) affirment que la fixation des composés phosphorés par les oxydes de fer et d'aluminium, et par la matière organique, ainsi que leur degré d'insolubilité sont responsables de la faible disponibilité des formes assimilables par les cultures. Ce phénomène s'avère encore plus sévère dans les sols acides tropicaux riches en argiles de type 1:1 et en sesquioxydes (Sanchez, 2002). Les valeurs du rapport P organique/P total obtenues (Tableau 3) indiquent que dans les sols étudiés, le phosphore existe cependant majoritairement sous forme organique, d'où besoin de l'activité biologique pour sa minéralisation.
29Les concentrations en SO4 obtenues dans les trois sols (Tableau 3) sont jugées faibles au point qu'une déficience en S pourrait avoir lieu. Le soufre inorganique (ion SO42-) qui est le plus assimilable par les plantes provient en grande partie de la minéralisation de la matière organique du sol. Selon Essington (2004) et Troeh et al. (2005), environ 90 % des concentrations totales du soufre dans les horizons de surface de la plupart des sols sont sous forme organique. Les faibles teneurs en matière organique dans les sols de Tonga et de Cyabayaga expliqueraient les faibles concentrations en S. D'après Voundi Nkana (1998), dans les conditions de forte acidité, plusieurs facteurs comme la faible oxydation du soufre, l'interférence entre celle-ci et la nitrification, la faible décomposition de la matière organique, les pertes des composés soufrés par lessivage peuvent contribuer à la déficience du soufre pour les plantes.
30Azote minéral et organique. Pour les trois sites, les teneurs en Nmin et Norg sont faibles, elles constituent seulement 0,4 à 0,8 % de Ntot présent dans les sols (Tableau 4). Pourtant, les formes minérales assimilables par les plantes sont aussi importantes dans le sol que l'azote total. Selon Brady et al. (2002), seulement 1,5 à 3,5 % de l'azote organique dans un sol minéralise chaque année. Au regard des proportions obtenues (Tableau 4), le taux de minéralisation diminue avec l'altitude. Entre les deux fractions assimilables, la forme N-NO3- est la plus représentée (8,4 à 9,4 mg.kg-1) sur les trois sites. Rutunga (1997) avait de son côté constaté que les sols non cultivés et sous jachère naturelle de la région de la Crête Congo-Nil étaient plutôt plus carencés en N-NO3-. Normalement, les bas pH affectent plus la nitrification que l'ammonification (Kemmitt et al., 2006), d'où la tendance des sols acides à accumuler en prédominance le N-NH4+ au détriment du N-NO3- (Kemmitt et al., 2005 ; Khalil et al., 2005).
31La proportion de l'azote organique dépasse 99 % de l'azote total présent dans les trois sols étudiés (Tableau 4). Pour mieux assurer la nutrition végétale, il faudra favoriser les activités biologiques qui réalisent les principales étapes de la minéralisation. Troeh et al. (2005) suggèrent qu'un sol devrait normalement avoir une quantité d'azote minéral dépassant 110 kg.ha-1, ce qui est loin d'être le cas pour les sols étudiés qui contiennent 34, 30 et 38 kg N.ha-1, respectivement pour Gakuta, Tonga et Cyabayaga.
32CECpH7 et CECE. Les valeurs de la CECpH7 obtenues sont de l'ordre de 18,0 ; 10,6 et 7,6 cmole(+).kg-1 respectivement pour Gakuta, Tonga et Cyabayaga (Tableau 5). La CECpH7 est moyenne à Gakuta et faible pour les deux autres. Cependant, dans les trois sols, la charge nette sur le complexe adsorbant est négative. Ceci est confirmé par la ∆pH (pHKCl-pHH2O) négative partout. En effet, dans des conditions d'acidité moyenne (pH ≥ 5,0), la charge nette des colloïdes minéraux de type 1:1 (i.e. kaolinite), même si faible, est encore négative (Menzies, 2003). En ajustant le pH à la neutralité lors de l'analyse, le complexe argilo-humique développe plus de charges négatives, ce qui justifie le fait que la CECpH7, qualifiée de CEC potentielle, est toujours supérieure à la CECE dans les sols acides fortement altérés et riches en sesquioxydes et en argiles de type 1:1. Les sols étudiés appartiennent aux ordres des Ultisols et Oxisols de la classification américaine Soil Taxonomy (Tableau 1). Dans ces conditions, il est conseillé d'utiliser la CECE car la CECpH7 surestime la valeur réelle de la charge du sol.
33Au vu des valeurs de la CECE obtenues (Tableau 5), les sols étudiés ont une capacité de rétention en éléments moyenne par rapport à la valeur de 4 cmole(+).kg-1 considérée comme seuil limite (Voundi Nkana, 1998). Il suffirait d'agir sur les pratiques permettant de rehausser le pH du sol pour augmenter la capacité de rétention et ainsi prévenir les pertes des éléments nutritifs par lessivage, plus particulièrement les cations basiques échangeables. En considérant que 1 % de la matière organique pourvoit une CEC de 2,5 cmole(-).kg-1, on trouve que la contribution de la fraction minérale à la CEC totale est inférieure à celle de la matière organique (Tableau 5), exception faite pour le site de Tonga.
34Bases échangeables et saturation en bases. Les teneurs en Ca dans les trois sols sont comprises dans la gamme de 2 et 4 cmole.kg-1 de sol (Tableau 5), considérée comme faible concentration (Landon, 1991). Pour cet auteur, les déficiences en calcium échangeable surviennent normalement seulement dans les sols de faible CEC à pH ≤ 5,5, ce qui est le cas pour les sites étudiés. Les valeurs obtenues pour le Mg sont aussi jugées faibles (Tableau 5), le site de Gakuta affiche la plus basse concentration (0,74 cmole.kg-1) qui le rapproche du seuil de déficience en magnésium dans les régions tropicales fixé à 0,5 cmole.kg-1. Les teneurs en K échangeable n'excèdent pas 0,2 cmole.kg-1 pour Gakuta et Tonga (Tableau 5). Les valeurs ne dépassant pas cette concentration sont considérées comme étant très faibles (Voundi Nkana, 1998). Dans l'ensemble, le site de Cyabayaga possède la meilleure condition en bases échangeables par rapport aux autres.
35Calculée par rapport à la CECE, la saturation en bases est moyenne à Gakuta (55 %), élevée à Tonga (84 %) et à Cyabayaga (95 %). Ce paramètre constitue un indicateur du niveau de fertilité d'un sol en termes de la disponibilité des éléments. L'absence de l'aluminium échangeable dans le sol de Cyabayaga justifie également la valeur élevée. Selon Voundi Nkana (1998), citant Liebhardt (1981)1, un sol idéal devrait avoir un complexe d'échange saturé à 65 % par le calcium, 10 % par le magnésium et 5 % par le potassium.
36A l'état actuel, les cations Ca, Mg et K occupent seulement 20, 4 et 1 % de charges négatives potentielles sur le complexe adsorbant à Gakuta ; 31, 12 et 2 % à Tonga, et 43, 23 et 14 % à Cyabayaga (données non présentées). Ainsi, pour obtenir un complexe d'échange idéal pour les sols en étude, des apports de l'ordre de 4,5 t CaO.ha-1 ; 0,43 t MgO.ha-1 et 0,63 t K2O.ha-1 à Gakuta ; 2,0 t CaO.ha-1 et 0,31 t K2O.ha-1 à Tonga et 0,94 t CaO.ha-1 à Cyabayaga peuvent être recommandés.
37Aluminium échangeable et saturation en aluminium. Le sol de Cyabayaga ne contient pas d'aluminium échangeable grâce à son pH relativement favorable par rapport aux autres sites (Tableau 5). En effet, à un pH supérieur à 5,5, l'aluminium ne se trouve pas dans les sols sous ses formes échangeables. Par contre, plus le pH descend en dessous de cette limite, les teneurs en aluminium échangeable augmentent, au point de devenir le cation le plus abondant du complexe d'échange (Menzies, 2003). Sur le site de Gakuta (pHH2O = 4,1), l'ion Al3+ est le second cation échangeable le plus présent et sature le complexe à 32 %. Des concentrations plus élevées en Al3+ ont été observées par Birasa et al. (1990) et Mbonigaba et al. (2005) dans les régions de la Crête Congo-Nil et du Plateau Central. Pour éliminer la part de l'aluminium échangeable dans ces régions, il faudrait, d'après la formule de Kamprath (1970), des quantités de chaux de 8,4 t CaCO3.ha-1 à Gakuta et 1,8 t CaCO3.ha-1 à Tonga. Pour le cas de Gakuta, il faudrait de faibles apports échelonnés dans le temps.
3.3. Caractéristiques microbiologiques
38N et C microbiens. Les valeurs obtenues pour Nmic (Tableau 6) montrent que l'immobilisation biologique est faible à Gakuta et à Tonga. En effet, il est connu que les micro-organismes peuvent se montrer compétitifs vis-à-vis des plantes pour ce qui est de l'azote assimilable dans le sol. Shi et al. (2006) évoquent que, dans certaines conditions environnementales, les bactéries hétérotrophes exercent un certain contrôle à la nitrification en assimilant plus de NH4+ que les bactéries nitrifiantes, ce qui peut conduire à un taux d'immobilisation plus élevé que celui de la nitrification.
39D'après Schinner et al. (1995), entre 2 et 6 % de l'azote du sol se trouve immobilisé dans les tissus des cellules microbiennes vivantes. Le rapport Nmic : Ntot varie de 0,4 à 2,6 % selon l'ordre Gakuta = Tonga < Cyabayaga (Tableau 7). Cet azote immobilisé par les micro-organismes peut cependant être re-minéralisé et devenir rapidement disponible pour les plantes car, selon Smith et al. (1990), la transformation de Nmic se fait 10 fois plus rapidement que celui immobilisé dans les résidus des plantes. Pour cela, une population microbienne plus active est nécessaire pour la synchronisation de la libération des éléments contenus dans la matière organique du sol (Tu et al., 2006).
40Le rapport Cmic : Corg, comme d'ailleurs Nmic : Ntot, est un indicateur permettant d'estimer la dynamique de la matière organique dans les sols (Flieβbach et al., 2007). Les valeurs du Cmic obtenues représentent moins de 1 % du carbone organique total (Tableau 7). Normalement, le carbone microbien varie de 1 à 5 % de la matière organique du sol (Smith et al., 1990). Le sol de Gakuta, qui pourtant contient plus de matière organique, dispose d'une plus faible proportion de Cmic que les deux autres. Le rapport Cmic : Corg est positivement corrélé avec le pH (r = 0,98 ; Tableau 8). Le quotient métabolique, encore appelé respiration spécifique, sert d'indicateur de l'état physiologique des micro-organismes du sol. Les valeurs obtenues varient de 0,51 à 0,67 mg C-CO2 (g Cmic)-1.h-1 dans l'ordre Gakuta > Cyabayaga > Tonga (Tableau 6). Selon Dilly (2005), le qCO2 dans les horizons supérieurs des sols cultivés varie de 0,5 à 10 mg C-CO2 (g Cmic)-1.h-1. Les valeurs de qCO2 élevées traduisent une mauvaise qualité du substrat et une faible efficience métabolique (Böhme et al., 2005 ; Flieβbach et al., 2007). Entre les trois zones, on peut déduire que c'est en région de haute altitude à sols fortement acides (site de Gakuta) que les micro-organismes du sol vivent sous des conditions environnementales plus stressantes.
41Le rapport Cmic : Nmic renseigne sur la structure de la population microbienne dans un sol (abondance relative des bactéries et des champignons). D'après Ross et al. (1993), les champignons disposent d'un rapport Cmic : Nmic plus élevé que les bactéries. Sur les sites de Gakuta et Tonga où il a été constaté une faible proportion de l'azote microbien par rapport à l'azote total et où les sols sont plus acides, les rapports Cmic : Nmic sont supérieurs à la valeur de 6,0 qui suggère, d'après Moore et al. (2000), une dominance des champignons dans la population microbienne. Des rapports Cmic : Nmic compris entre 10 et 14 ont été également obtenus par Agbenin et al. (2005) dans un sol acide tropical du nord du Nigeria.
42Respiration du sol et carbone facilement assimilable. La respiration basale (RB) est très faible dans les trois sols étudiés 0,30 ; 0,24 et 0,37 µg CO2.h-1.g-1 de sol sec, respectivement pour Gakuta, Tonga et Cyabayaga (Tableau 6). La qualité de la matière organique et la déficience en certains éléments majeurs dans les sols pourraient expliquer cette tendance (Ilstedt et al., 2005). La fraction du Cfm comme composante du carbone organique total est aussi faible, plus particulièrement à Gakuta (Tableau 6). Les valeurs obtenues représentent 5, 12 et 11 du % Corg, respectivement pour Gakuta, Tonga et Cyabayaga. Néanmoins, du point de vue développement microbien, c'est le rapport Cmic : Corg qui indique le mieux la qualité de la matière organique du sol (Flieβbach et al., 2007). Cette tendance est confirmée par la corrélation positive entre la RB et le rapport Cmic : Corg (r = 0,42) d'une part, et avec le pH d'autre part (r = 0,57) (Tableau 8).
43La respiration induite par substrat (RIS) est beaucoup plus élevée que la RB (Tableau 6). Il a déjà été démontré que l'oxydation de la matière organique du sol par la microflore hétérotrophe peut à son tour être limitée par la disponibilité d'autres éléments nutritifs (Cleveland et al., 2002 ; Giesler et al., 2004 ; Teklay et al., 2006). L'apport d'un substrat à base de C (C6H12O6), P (KH2PO4) et N [(NH4)2SO4] dans le cas de la présente étude a permis de révéler le potentiel respiratoire des sols. Les faibles valeurs du quotient d'activation respiratoire (QR) indiquent que les micro-organismes ont réagi favorablement au substrat apporté. Les valeurs de QR supérieures à 0,3 caractérisent les sols pollués ou contaminés (ISO, 2002).
44Activités enzymatiques. Les valeurs obtenues pour l'activité de la déshydrogénase et de la phosphomonoestérase acide sont comprises entre 0,13-0,37 µg TPF.j-1.g-1 de sol sec pour le premier et entre 1,83 - 2,35 µg PNP.h-1.g-1 de sol sec pour le second (Tableau 9). L'amplitude des réactions obtenues pour ces paramètres suit la distribution de la matière organique entre les trois sites dans l'ordre Gakuta > Tonga > Cyabayaga. Cette relation a été observée par plusieurs autres auteurs (Garcia et al., 1997 ; Pascual et al., 1998 ; Biederbeck et al., 2005 ; Tejada et al., 2006). En effet, les oxydoréductases (i.e. déshydrogénase) et les hydrolases (i.e. phosphatase) agissent sur le processus de base de la décomposition de la matière organique du sol, ce qui leur confère une forte relation avec la quantité et la qualité de celle-ci. Particulièrement, la déshydrogénase est une enzyme intracellulaire qui est impliquée dans le métabolisme oxydoréductase des micro-organismes. Etant donné qu'elle agit uniquement dans les cellules vivantes, son activité dépend de l'état métabolique de la biomasse microbienne du sol. Les résultats obtenus montrent que son activité est effectivement corrélée positivement avec le rapport Cmic : Nmic. Comparé aux résultats obtenus dans les études de Lee et al. (2004) et Caravaca et al. (2005) sur les sols disposant des caractéristiques proches des nôtres à l'exclusion du pH, l'activité de la déshydrogénase est faible dans les trois sols en étude. D'après Alef (1995), les sols acides (pH < 5) montrent une très faible activité de la déshydrogénase et l'interprétation des résultats doit être faite avec beaucoup de précaution.
45Contrairement à ce qu'on pouvait attendre, la phosphatase acide est négativement corrélée avec le phosphore extractible (Tableau 9). Garcia-Gil et al. (2000) affirment que cette enzyme est plus active dans les sols lorsqu'il y a peu de P disponible dans le milieu. Monokrousos et al. (2006) ont quant à eux trouvé que seule l'activité de la phosphatase alcaline n'était pas influencée par la teneur en phosphore disponible. D'après Ros et al. (2003), d'autres facteurs physico-chimiques, notamment le pH et la texture, interviennent pour modifier le comportement normal des enzymes dans les sols. Les valeurs de l'activité de la phosphatase acide obtenues par Pérez-de-Mora et al. (2006) dans un sol argilo-limoneux fortement acide d'Espagne (pH 4,4) sont plus élevées que celles de nos sols. Alef et al. (1995) recommandent la prudence dans la détermination de la phosphomonoestérase dans les sols acides car dans ces conditions, le p-nitrophenyl phosphate (PNP) s'hydrolyse très rapidement en p-nitrophénol. Les mêmes auteurs ajoutent également que l'extraction du p-nitrophénol est souvent incomplète dans les sols riches en fer et en aluminium.
4. Conclusion
46Dans les zones de haute et moyenne altitudes, représentées par les stations de Gakuta et de Tonga, l'acidité, caractérisée par les faibles valeurs de pH et la toxicité aluminique, s'avère comme principale contrainte de nature chimique limitant la production agricole. Du point de vue capacité d'échange cationique, le sol de Gakuta est potentiellement fertile, mais actuellement une bonne partie du complexe adsorbant est saturé par l'aluminium échangeable. Théoriquement, des quantités de chaux proches de 10 et 2 tonnes de CaCO3.ha-1 permettraient de neutraliser l'aluminium et de remonter le pH, mais avec comme défaut de n'apporter que du calcium comme cation. Dans la pratique cependant, il est conseillé de ne jamais apporter plus de 2 t.ha-1 en équivalent chaux en une fois. Une matière organique de bonne qualité serait une solution plus durable. L'acidité contrarie remarquablement la fertilité biologique définie par la structure et l'activité de la biomasse microbienne dans cette région. Quoique la réserve en matière organique soit satisfaisante à Gakuta, la faible activité biologique présage qu'elle ne soit pas de bonne qualité et donc peu profitable aux sols et aux micro-organismes. Les fortes corrélations observées entre les deux mesures respirométriques et le P-Bray2 (r = 0,99 et 0,85) indiquent que l'indisponibilité de P pourrait constituer une limitation à l'activité microbienne dans les sols acides tropicaux.
47En région de basse altitude (station de Cyabayaga), le degré d'acidité due au pH se trouve à la limite de l'acceptable, les formes échangeables de l'aluminium étant jusque-là absentes dans les sols. Des mesures adéquates de gestion des sols cultivés devraient permettre de maintenir ou d'améliorer l'état actuel des sols. Du point de vue saturation en bases et disponibilité du phosphore, cette zone présente de meilleures conditions nutritionnelles. Cependant, même si les indicateurs de la santé biologique (i.e. Nmic, Cmic, RIS) et de la qualité de la matière organique (i.e. Cmic : Corg et Cmic : Nmic) sont favorables par rapport aux autres sites, les stocks en carbone et en azote organiques restent faibles au point de constituer des contraintes sévères à la production agricole si des systèmes culturaux appropriés ne sont pas rapidement adoptés.
Bibliographie
Agbenin J.O. & Adeniyi T., 2005. The microbial biomass properties of a savanna soil under improved grass and legume pastures in northern Nigeria. Agric. Ecosystems Environ., 109, 245-254.
Alef K., 1995. Dehydrogenase activity. In: Alef K. & Nannipieri P., eds. Methods in applied soil microbiology and biochemistry. London: Academic Press Limited, 228-231.
Alef K., Nannipieri P. & Trazar-Cepada C., 1995. Phosphatase activity. In: Alef K. & Nannipieri P., eds. Methods in applied soil microbiology and biochemistry. London: Academic Press Limited, 335-344.
Beernaert F.R., 1999. Etude de faisabilité d'un projet de production de chaux et du travertin pour la gestion des sols acides au Rwanda. Rapport agropédologique, mission du 19.06 au 15.08.1999. Kigali : PRO-INTER Project Consultants.
Biederbeck V.O., Zentner R.P. & Campbell C.A., 2005. Soil microbial population and activities as influenced by legume green fallow in a semiarid climate. Soil Biol. Biochem., 37, 1775-1784.
Birasa E.C. et al., 1990. Rwanda. Les sols du Rwanda : méthodologie, légende et classification. Carte Pédologique du Rwanda. Kigali : CTB ; MINAGRI.
Blake R.G. & Hartage K.H., 1986. Bulk density. In: Klute A., ed. Methods of soils analysis. Part 1. 2nd ed. Madison, WI, USA: American Society of Agronomy, 363-375.
Böhme L., Langer U. & Böhme F., 2005. Microbial biomass, enzyme activities and microbial community structure in two European long-term field experiments. Agric. Ecosystems Environ., 109, 141-152.
Borken W., Muhs A. & Beese F., 2002. Application of compost in spruce forests: effects on soil respiration, basal respiration and microbial biomass. Forest Ecol. Manage., 159, 49-58.
Brady N.C. & Weil R.R., 2002. The nature and properties of soils. 13th ed. Upper Saddle River, NJ, USA: Pearson Education Inc.
Caravaca F. et al., 2005. A microcosm approach to assessing the effect of earthworm and biological properties in an amended semiarid soil. Chemosphere, 59, 1625-1631.
Cleveland C.C., Townsend A.R. & Schmidt S.K., 2002. Phosphorus limitation of microbial processes in moist tropical forests: evidence from short-term laboratory incubations and field studies. Ecosystems, 5, 680-691.
Cookson W.R. et al., 2005. The contribution of soil organic matter fractions to carbon and nitrogen mineralization and microbial community size and structure. Soil Biol. Biochem., 37, 1726-1737.
Davet P., 1996. Vie microbienne du sol et production végétale. Paris : INRA Editions.
Delpierre G., 1974. Les régions agricoles du Rwanda. Note technique 13. Butare, Rwanda : Institut des Sciences Agronomiques du Rwanda (ISAR).
Dilly O., 2005. Microbial energetics in soils. In: Buscot F. & Varma A., eds. Microorganisms in soils: roles in genesis and functions. Berlin; Heidelberg, Germany: Springer-Verlag, 123-138.
Drechsel P., Steiner K.G. & Hagerdorn F., 1996. A review on the potential of improved fallows and green manure in Rwanda. Agroforestry Syst., 33, 109-136.
Essington M.E., 2004. Soil and water chemistry. An integrated approach. Boca Raton, FL, USA: CRC Press.
Flieβbach A., Oberholzer H.R., Gunst L. & Mäder P., 2007. Soil organic matter and biological soil quality indicators after 21 years of organic and conventional farming. Agric. Ecosystems Environ., 118, 273-274.
Franco I., Contin M., Bragato G. & De Nobili M., 2004. Microbiological resilience of soils contaminated with crude oil. Geoderma, 121, 17-30.
Garcia C., Hernandez T. & Costa F., 1997. Potential use of dehydrogenase activity as an index of microbial activity in degraded soils. Commun. Soil Sci. Plant Anal., 1(2), 123-134.
Garcia-Gil J.C., Plaza C., Soler-Rovira P. & Polo A., 2000. Long-term effects of municipal solid waste composts application on soil enzyme activities and microbial biomass. Soil Biol. Biochem., 32, 1907-1913.
Giesler R., Satoh F., Ilstedt U. & Nordgren A., 2004. Microbial available phosphorus in boreal forests: effects of aluminium and iron accumulation in the humus layer. Ecosystems, 7, 208-217.
Gil-Sotres F., Trasar-Cepeda C., Leiros M.C. & Seoane S., 2005. Different approaches to evaluating soil quality using biochemical properties. Soil Biol. Biochem., 37, 877-887.
Groffman P.M., McDowell W.H., Myers J.C. & Merriam J.L., 2001. Soil microbial biomass and activity in tropical riparian forest. Soil Biol. Biochem., 33, 1339-1348.
Ilstedt U. & Singh S., 2005. Nitrogen and phosphorus limitations of microbial respiration in a tropical phosphorus-fixing acrisol (Ultisol) compared with compost. Soil Biol. Biochem., 37, 1407-1410.
Islam K.R. & Weil R.R., 2000. Land use effects on soil quality into tropical forest ecosystem of Bangladesh. Agric. Ecosystems Environ., 79, 9-16.
ISO, 1997. Soil quality. Determination of soil microbial biomass. Part 1: Substrate-induced respiration method. ISO 14240-1:1997. Geneva, Switzerland: International Standard Organisation.
ISO, 2002. Soil quality. Determination of abundance and activity of soil microflora using respiration curves. ISO 17155:2002 (E). Geneva, Switzerland: International Standard Organisation.
Joergenson R.G., 1995. The fumigation-extraction method for microbial biomass nitrogen In: Alef K. & Nannipieri P., eds. Methods in applied soil microbiology and biochemistry. London: Academic Press Limited, 388-390.
Kamprath E.J., 1970. Exchangeable aluminium as a criterion for liming leached mineral soils. Soil Sci. Soc. Am. J., 24, 252-254.
Kemmitt S.J., Wright D. & Jones D.L., 2005. Soil acidification used as a management strategy to reduce nitrate losses from agricultural land. Soil Biol. Biochem., 37, 867-875.
Kemmitt S.J., Wright D., Goulding K.W.T. & Jones D.L., 2006. pH regulation of carbon and nitrogen dynamics in two agricultural soils. Soil Biol. Biochem., 38, 898-911.
Khalil M.I., Hossain M.B. & Schmidhalter U., 2005. Carbon and nitrogen mineralization in different upland soils of the subtropics treated with organic materials. Soil Biol. Biochem., 37, 1507-1518.
Klute A., 1986. Water retention: laboratory methods. In: Klute A., ed. Methods of soil analysis. Part 1. 2nd ed. Madison, WI, USA: American Society of Agronomy, 635-662.
Klute A. & Dirksen C., 1986. Hydraulic conductivity and diffusivity: laboratory methods. In: Klute A., ed. Methods of soil analysis. Part 1. 2nd ed. Madison, WI, USA: American Society of Agronomy, 687-734.
Landon J.R., 1991. Booker tropical soil manual. A handbook for soil survey and agricultural land evaluation in the tropics and subtropics. Oxon, UK: Booker Tate Limited; Harlow, Essex, UK: Longman.
Lee J.J. et al., 2004. Effect of food waste compost on microbial population, soil enzyme activity and lettuce growth. Bioresource Technol., 93, 21-28.
Mbonigaba J.J., Nzeyimana I. & Mpagaritswenimana V., 2005. Etude pédologique de trois sols acides du Rwanda (séries « Gisovu », « Gako » et « Gakirage ») en comparaison aux données fournies par la Carte Pédologique du Rwanda. Butare, Rwanda : Université Nationale.
Menzies N.W., 2003. Toxic elements in acidic soils: chemistry and measurement. In: Rengel Z., ed. Handbook of soil acidity. New York, USA: Marcel Dekker, 267-296.
Monokrousos N., Papatheodorou E.M., Diamantopoulos J.D. & Stamou G.P., 2006. Soil quality variables in organically and conventionally cultivated field sites. Soil Biol. Biochem., 38, 1282-1289.
Moore J.M., Klose S. & Tabatabai A.M., 2000. Soil microbial biomass carbon and nitrogen as affected by cropping systems. Biol. Fertil. Soils, 31, 200-210.
Nannipieri P., Grego S. & Ceccenti B., 1990. Ecological significance of the biological activity in soil. In: Bollag J.M. & Stotzky G., eds. Soil biochemistry. Vol. 6. New York, USA: Marcel Dekker, 293-355.
Pascual J.A., Hernandez M.T., Garcia C. & Ayuso M., 1998. Enzymatic activities in an arid soil amended with urban organic wastes: laboratory experiment. Bioresource Technol., 64, 131-138.
Pauwels J.M., van Ranst E., Verloo M. & Mvendo ZE A., 1992. Manuel de laboratoire de pédologie. Méthodes d'analyses des sols et des plantes, équipements, gestion de stocks de verrerie et de produits chimiques. Bruxelles : Administration Générale de la Coopération au Développement (AGCD).
Pérez-de-Mora A. et al., 2006. Microbial community structure and function in a soil contaminated by heavy metals: effects of growth and different amendments. Soil Biol. Biochem., 38, 327-341.
Perucci P. et al., 2000. Effects of organic amendment and herbicide treatment on soil microbial biomass. Biol. Fertil. Soils, 32, 17-23.
Prosser J.I., 1997. Microbial processes within the soil. In: Dirk van Elsas J., Trevors J.T. & Wellington E.M.H., eds. Modern soil microbiology. New York, USA: Marcel Dekker, 183-213.
Pulleman M.M., Bouma J., Essen E.A. & Meijles E.W., 2000. Soil organic matter content as a function of different land uses history. Soil Sci. Soc. Am. J., 64, 689-693.
Ros M., Hernandez M.T. & Garcia C., 2003. Soil microbial activity after restoration of a semiarid soil by organic amendments. Soil Biol. Biochem., 35, 463-469.
Ross D.J. & Sparling G.P., 1993. Comparison of methods to estimate microbial C in litter and soil under Pinus radiata on coastal sand. Soil Biol. Biochem., 25, 1591-1599.
Rutunga V., 1997. Sols acides de la région d'altitude de la Crête Congo-Nil (Rwanda). Potentialités agricoles et forestières. Nairobi, Kenya: Lengo Publisher.
Sanchez P.A., 2002. Soil fertility and hunger in Africa. Science, 295, 2019-2020.
Scharpenseel H.W., 1987. Organic matter characteristics. In: Lathan M. Proceedings of the IBSRAM session on land development and management of acid soils in Africa, 21-27 January 1986, Douala, Cameroun. Douala, Cameroun: IBSRAM, 83-100.
Schinner F., Öhlinger R., Kandeler E. & Margesin R., 1995. Methods in soil biology. Berlin; Heidelberg, Germany; New York, USA: Springer-Verlag.
Schloter M., Dilly O. & Munch J.C., 2003. Indicators for evaluating soil quality. Agric. Ecosystems Environ., 98, 255-262.
Shi W., Huaiying Y. & Bowman D., 2006. Soil microbial biomass, activity and nitrogen transformations in a turfgrass chronosequence. Soil Biol. Biochem., 38, 311-319.
Smith L.J. & Paul E.A., 1990. The significance of soil biomass estimations. In: Bollag J.M. & Stotzky G., eds. Soil biochemistry. Vol. 6. New York, USA: Marcel Dekker, 357-396.
Sparling G.P., 1995. The substrate-induced respiration method. In: Alef K. & Nannipieri P., eds. Methods in applied soil microbiology and biochemistry. London: Academic Press Limited, 397-404.
Tejada M., Garcia C., Gonzalez J.L. & Hernandez M.T., 2006. Use of organic amendments as a strategy for saline soil remediation: influence on the physical, chemical and biological properties of soil. Soil Biol. Biochem., 38(6), 1413-1421.
Teklay T., Nordgren A. & Malmer A., 2006. Soil respiration characteristics of tropical soils from agricultural and forestry land-use at Wondo Genet (Ethiopia) in response to C, N and P amendments. Soil Biol. Biochem., 38, 125-133.
Troeh F.R. & Thompson L.M., 2005. Soils and soil fertility. 6th ed. Oxford, UK: Blackwell Publishing.
Tu C. et al., 2006. Response of soil microbial and N availability to transition strategies from conventional to organic farming systems. Agric. Ecosystems Environ., 113, 206-215.
Vander Zaag P. et al., 1984. An assessment of chemical properties for soils of Rwanda with the use of geostatistical techniques. Geoderma, 34, 293-314.
Verdoodt A. & van Ranst E., 2003. Land evaluation for agricultural production in the tropics. A large-scale land suitability classification for Rwanda. Ghent, Belgium: Ghent University, Laboratory of Soil Science.
Voundi Nkana J.C., 1998. Utilisation des déchets de l'industrie du bois en vue de l'amélioration de la fertilité chimique des sols acides tropicaux. Thèse de doctorat : Université de Gand (Belgique).
Wang W.J., Dalal R.C., Moody P.W. & Smith C.J., 2003. Relationships of respiration to microbial biomass, substrate availability and clay content. Soil Biol. Biochem., 35, 273-284.
White R.E., 2006. Principles and practice of soil science. The soil as a natural resource. 4th ed. Malden, USA: Blackwell Publishing.
Notes
Pour citer cet article
A propos de : Jean Jacques Mbonigaba Muhinda
Université Nationale du Rwanda. Faculté d'Agronomie. Département Sol et Gestion de l'Environnement. B.P. 56. RWA-Butare (Rwanda). E-mail : jmbonigaba@nur.ac.rw, mbonjac@yahoo.fr
A propos de : Innocent Nzeyimana
Université Nationale du Rwanda. Faculté d'Agronomie. Département Sol et Gestion de l'Environnement. B.P. 56. RWA-Butare (Rwanda).
A propos de : Charles Bucagu
Université Nationale du Rwanda. Faculté d'Agronomie. Département Production végétale et Horticulture. B.P. 56. RWA-Butare (Rwanda).
A propos de : Marc Culot
Univ. Liège - Gembloux Agro-Bio Tech. Laboratoire d'Ecologie microbienne et d'Epuration des Eaux. Avenue Maréchal Juin, 27. Bât. 52. B-5030 Gembloux (Belgique).





