- Accueil
- volume 12 (2008)
- numéro 2
- Les lipases sont des hydrolases atypiques : principales caractéristiques et applications
Visualisation(s): 60091 (257 ULiège)
Téléchargement(s): 1150 (16 ULiège)
Les lipases sont des hydrolases atypiques : principales caractéristiques et applications

Notes de la rédaction
Reçu le 7 septembre 2004, accepté le 13 novembre 2007
Résumé
Les triacylglycérol acyl-hydrolases, ou lipases, sont des enzymes atypiques de par leur mécanisme d'action et leur spécificité de substrats. En fonction du micro-environnement de l'enzyme, elles peuvent agir en tant qu'hydrolases en milieu aqueux ou comme catalyseurs en synthèse organique. En tant qu'hydrolases, elles sont responsables du catabolisme des triglycérides, leurs substrats préférentiels, en acide gras et en glycérol. Chez de nombreux êtres vivants, cette réaction est capitale de par son rôle physiologique majeur dans le métabolisme des graisses et des lipides. De plus, certaines lipases sont capables d'hydrolyser des phospholipides, des esters de cholestérol et même parfois certains esters synthétiques. En milieu solvant, elles peuvent catalyser bon nombre de réactions allant de l'estérification à l'acidolyse ou l'alcoolyse tout en présentant une certaine énantio-, régio- et chimio-sélectivité. Les lipases forment une classe d'enzymes hétérogènes de par leur origine, qu'elles soient animales, végétales ou microbiennes, ce qui augmente encore leurs potentialités. Toutes ces propriétés ont conduit au développement de nombreuses applications aussi bien au point de vue industriel, notamment dans l'industrie agro-alimentaire et dans l'industrie chimique, qu'en médecine humaine.
Abstract
Lipases are atypical hydrolases: principal characteristics and applications. Due to their kinetic and substrate specificities, triacylglycerol acyl-hydrolases or lipases are atypical enzymes. In function of their microenvironment, lipases are able to act as hydrolases in aqueous solution or as biocatalysts in organic synthesis. As hydrolases, they are responsible of the triglycerids catabolism into fatty acids and glycerol. In many organisms, this reaction plays a major role in the fat and lipid metabolism. In addition, lipases are also able to hydrolyse phospholipids and cholesterol esters. In organic solvent, lipases could catalyse reactions such as esterifications, acidolysis or alcoolysis with enantio-, regio- and chimioselectivity. Lipases form a mixed class of enzyme due to their animal, vegetal or microbial origins. All those properties led to the development of many applications in the food and chemical industries but also in the medical and therapeutic field.
Table des matières
1. Introduction
1Les lipases forment une famille hétérogène d'enzymes capables d'hydrolyser les triglycérides à longues chaînes d'acides gras en glycerol et en acides gras correspondants. Elles ont été mises en évidence, dès 1901, chez des bactéries telles que Bacillus prodigiosus, Bacillus pyocyaneus et Bacillus fluorescens (maintenant dénommées respectivement Serratia marcescens, Pseudomonas aeruginasa et Pseudomonas fluorescens) (Eijkmann et al., 1901). Cependant, ce n'est qu'à partir de la fin des années 1950 que l'étude des lipases a réellement pris son essor, notamment avec les travaux de l'équipe de Desnuelle à Marseille sur la lipase pancréatique de porc.
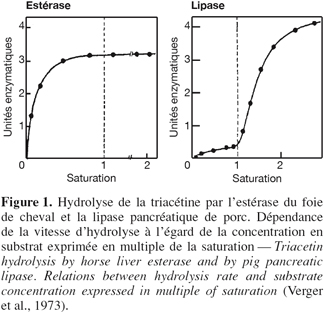
2Les lipases constituent une classe particulière d'estérases capables d'hydrolyser des esters carboxyliques agrégés en phase aqueuse (Sarda et al., 1958). La réaction de catalyse nécessite une molécule d'eau et se déroule à l'interface eau / substrat insoluble. Cette particularité catalytique a été démontrée en représentant les vitesses initiales d'hydrolyse en fonction de la concentration en substrat (Figure 1). En solution moléculaire vraie, c'est-à-dire en dessous de la concentration micellaire critique du substrat (CMC), les vitesses d'hydrolyse sont faibles. Par contre, au-dessus de cette concentration critique, les molécules de substrat prennent la forme de micelles, d'une émulsion ou d'un film mono-moléculaire aboutissant à la formation d'une interface eau / huile. La formation de cette interface a pour conséquence une augmentation brutale de la vitesse de lipolyse (Verger et al., 1973). De ces observations a émergé la notion de phénomène d'activation interfaciale. Ce critère a longtemps servi de critère de discrimination entre les lipases et les estérases. Malheureusement, il s'est montré par la suite insuffisant pour bon nombre d'enzymes lipolytiques en raison des profils de vitesse initiale très variables et difficiles à interpréter (Egloff et al., 1995). Dès lors, les lipases ont été redéfinies comme étant des carboxyl-estérases catalysant l'hydrolyse d'acylglycérides à longues chaînes d'acides gras. Le fait que les lipases montrent une activité particulièrement élevée sur des lipides riches en triglycérides (huile d'olive, beurre, graisses animales et végétales, etc.) a conduit au choix du terme triacylglycérol acyl-hydrolase (E.C.3.1.1.3) comme dénomination officielle. Les lipases sont également couramment dénommées triglycérides lipases ou tributyrases. D'autres catégories d'enzymes lipolytiques ont également été définies, principalement en fonction du type de lipides qu'elles hydrolysent préférentiellement. La plupart d'entre elles sont d'origine pancréatique telles que la phospholipase A2, la lysophospholipase et la cholestérol-ester lipase. Cependant, la spécificité des lipases est rarement absolue puisqu'elle s'étend parfois aux phospholipides, aux esters de cholestérol, aux tri-, di- et monoglycérides et même parfois aux esters synthétiques à chaînes hydrocarbonées plus ou moins longues. La dénomination des lipases repose donc essentiellement sur la nature des substrats hydrolysés préférentiellement. Toutefois, on peut distinguer d'une part les lipases au sens strict, présentant une activation interfaciale et d'autre part, les carboxyl-ester hydrolases, très peu actives sur les triglycérides à longues chaînes, ne nécessitant pas d'activation interfaciale mais capables d'hydrolyser une large gamme de substrats lipidiques. En plus de leur capacité d'hydrolyser les graisses, les lipases peuvent catalyser bon nombre de réactions allant de l'hydrolyse à l'estérification sans oublier les réactions d'alcoolyse et d'acidolyse (Figure 2). Cette particularité des lipases de catalyser diverses réactions en fonction du micro-environement de l'enzyme, ainsi que leurs spécificités et leurs conditions douces de réactions, les rendent intéressantes du point de vue industriel.

2. Origines et classification des lipases
3Les lipases sont largement répandues dans la nature où elles ont un rôle physiologique important dans le métabolisme des graisses. On les retrouve aussi bien dans le règne végétal, chez les invertébrés et les vertébrés mais également chez de nombreux micro-organismes, principalement sous forme de protéines extracellulaires.
2.1. Les lipases végétales
4Les lipases sont largement répandues au sein de la plante bien qu'on les retrouve principalement dans les graines où les triglycérides sont stockés dans des structures intracellulaires appelées oléosomes (ou oil bodies) (Beisson et al., 2001). Sous l'action des lipases, ces triglycérides sont hydrolysés sous forme d'acides gras dont le rôle est de fournir l'énergie nécessaire à la germination de la graine et au développement de la jeune plante (Adlercreutz et al., 1997).
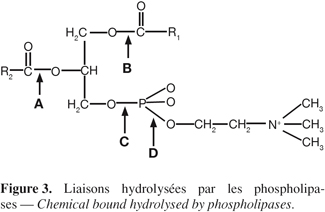
5Les lipases végétales peuvent être classées en trois grands groupes. Le premier groupe est constitué par les triacylglycérol hydrolases qui sont principalement présentes dans les graines. Leur étude revêt une importance économique capitale puisqu'elles sont responsables en grande partie de l'altération des graines pendant le stockage. Les constituants du second groupe, dénommés acylhydrolases, sont présents dans divers tissus de la plante. Ces enzymes présentent peu de spécificité pour leur substrat ; elles sont incapables d'hydrolyser les triglycérides mais elles peuvent catalyser certaines réactions de transestérification (Hills et al., 1990). Les principales acylhydrolases sont les phospholipases A et B ; les glycolipases, les sulfolipases et les monoglycéride lipases. Le troisième groupe est constitué par les phospholipases C et D. Les liaisons hydrolysées par les phospholipases sont représentées à la figure 3.
6Les lipases végétales interviennent également dans le métabolisme, le réarrangement et la dégradation de la chlorophylle lors de la croissance et de la sénescence des feuilles ainsi que dans le processus de mûrissement des fruits. Par exemple, les chlorophylases (chlorophylle-chlorophylido hydrolases), présentes dans la membrane des thylakoïdes des chloroplastes, interviennent dans le catabolisme de la chlorophylle (Tsuchiya et al., 1999).
7Chez les plantes supérieures, les lipases interviennent dans la biosynthèse de transducteur intervenant dans les mécanismes de régulation ou de défense contre une variété de pathogènes. En effet, les oxylipines octadécanoïques telles que l'acide jasmonique sont synthétisées à partir d'acides gras, notamment d'acide α−linolénique, en présence de lipases membranaires (Farmer et al., 1992 ; Stelmach et al., 2001).
8Certaines protéines végétales possédant une activité lipolytique peuvent avoir un effet cytotoxique pour les cellules animales. Par exemple, la ricine, une glycoprotéine isolée de la graine de Ricinus communis, induit le blocage de la synthèse des protéines par inactivation des ribosomes (Lord et al., 1994 ; Lombard et al., 2001 ; Morlon-Guyot et al., 2003). Leur étude a permis leur utilisation comme immunotoxines dans le traitement de certains cancers (Girbes et al., 1996).
9D'un point de vue industriel, l'intérêt des lipases végétales n'a cessé de s'accroître depuis quelques années, notamment dans le domaine de la biotransformation de lipides. En effet, les lipases végétales sont facilement isolées à partir de graines (Hassanien et al., 1986) et elles présentent des spécificités de substrat atypique comparées aux lipases microbiennes (Pahoja et al., 2002). Par exemple, la lipase des graines de colza (Brassica napus), obtenue par simple homogénéisation de graine dans un tampon adéquat, est utilisée industriellement dans la modification d'huile de tournesol ou dans l'enrichissement de l'huile de primevère en acide γ-linolénique (Hassanien et al., 1986 ; Hills et al., 1989).
2.2. Les lipases de mammifères
10Les lipides constituent pour les mammifères une source énergétique essentielle et avantageuse de par leur faible densité. Chez l'homme, ainsi que chez d'autres vertébrés, les lipases interviennent dans le contrôle de la digestion, de l'absorption et de la reconstitution des graisses. Les lipases de mammifères peuvent être classées en trois groupes. Le premier est constitué par les lipases associées à la digestion, telles que les lipases linguale, pharyngale, gastrique et pancréatique. Le second groupe correspond aux lipases présentes dans le cerveau, les muscles, les artères, les reins, la rate, la langue, le foie et les tissus adipeux. Le troisième groupe correspond aux lipases produites par les glandes galactogènes produisant le lait maternel. En effet, les lipases jouent un rôle important dans la digestion chez le nouveau-né dont l'alimentation est riche en lipides (Baba et al., 1991). Les tissus adipeux contiennent également une lipase hormonosensible qui est activée par les hormones lipolytiques, telles que le glucagon, via un mécanisme de phosphorylation et déphosphorylation spécifique dépendant de l'AMP cyclique.
11Les lipases de mammifères les plus étudiées sont les lipases liées à la digestion des graisses et à leur absorption. Il s'agit de la lipase gastrique, de la lipase pancréatique, de la lipoprotéine lipase et de la lipase hépatique. Des études de la structure de leurs gènes suggèrent que ces différents enzymes dérivent d'un ancêtre commun (Warden et al., 1993).
12La lipase gastrique, sécrétée par la muqueuse gastrique, hydrolyse les lipides alimentaires dans l'estomac. Elle ne nécessite pas la présence de cofacteurs pour être active ; elle est stable et active à des valeurs de pH proches de 1 et elle est résistante à la pepsine ainsi qu'aux protéases gastriques (Canaan et al., 1999 ; Miled et al., 2000 ; Miled et al., 2003).
13La lipase pancréatique est le principal enzyme responsable de la digestion des lipides alimentaires. Elle agit principalement sur les diglycérides libérés par la lipase gastrique. Elle est sécrétée dans le duodénum et fonctionne à des pH légèrement alcalins, contrairement à la lipase gastrique. Les produits de la lipolyse sont, suite à son action, véhiculés à l'aide des agents tensioactifs naturels que sont les sels biliaires. L'activité de la lipase pancréatique peut s'exercer en présence ou en absence des sels biliaires. En leur absence, la lipase s'adsorbe d'abord à l'interface lipide / eau avant d'hydrolyser les esters carboxyliques. Par contre, en présence de ces sels biliaires, la lipase pancréatique est inactive, mais son activité est restaurée par un cofacteur protéique appelé colipase (Borgstrom et al., 1973). Les sels biliaires sont essentiels pour l'assimilation des lipides. En effet, sans l'interface eau / lipide de l'émulsion formée avec les sels biliaires, la lipolyse des triglycérides serait 2 à 4 fois moins efficace (Borgstrom, 1975).
14La lipoprotéine lipase joue un rôle dans le métabolisme intermédiaire des lipides. Elle permet l'hydrolyse et l'absorption, par les tissus, des triglycérides transportés dans le sang sous forme de lipoprotéines (VLDL, LDL, HDL). La lipase hépatique joue également un rôle dans le métabolisme des lipoprotéines circulant dans le sang. Elle est capable d'hydrolyser les glycérides, les phospholipides et les esters de cholestérol. Elle peut aussi catalyser la trans-estérification entre glycérides.
2.3. Les lipases microbiennes
15Les lipases sont largement répandues chez les bactéries, les levures et les champignons filamenteux. Elles sont aussi bien produites chez les bactéries Gram + telles que celles des genres Bacillus et Staphylococcus que par des bactéries Gram – telles que Pseudomonas. Elles sont également largement répandues chez les levures du genre Candida ou Geotrichum ainsi que chez les champignons filamenteux tels que Rhizopus ou Thermomyces.
16Bien que les premières lipases étudiées étaient d'origine animale, l'intérêt des lipases microbiennes n'a cessé de s'accroître au cours des 25 dernières années, principalement en raison du grand nombre d'applications qu'elles offrent dans des domaines très variés. Les lipases microbiennes présentent comme avantages d'une part, d'avoir des procédés de fabrication relativement simples comparés aux lipases d'origine animale et d'autre part, d'avoir une plus grande stabilité vis-à-vis de la température, des détergents et des enzymes protéolytiques. Ces caractéristiques ont permis le développement de nombreuses applications pour les lipases microbiennes qui ont abouti à de nombreux produits commerciaux.
2.4. Les cutinases
17Les cutinases sont des enzymes produites par différents champignons pathogènes et phytopathogènes tels que Fusarium solani, qui est l'agent responsable de la formation de mycétome chez l'homme (Yera et al., 2003) ou tels que Fusarium oxysporum radicis-lycopersici qui est responsable de la pourriture de la racine et du collet chez la tomate et certaines céréales (Tan et al., 2003). Les cutinases sont capables de dégrader la cuticule des végétaux en clivant les liaisons esters des polymères de cutine. Elles sont également capables d'hydrolyser des triglycérides à courtes et longues chaînes d'acides gras avec une efficacité comparable à celle de la lipase pancréatique (Longhi et al., 1999). Les cutinases sont des enzymes qui peuvent être apparentées aux lipases et estérases à la différence qu'elles ne nécessitent pas d'activation interfaciale pour être efficaces (Martinez, 1992). Comme elles sont actives aussi bien en solution moléculaire vraie qu'en système biphasique, les cutinases sont en quelque sorte le lien entre estérases et lipases.
3. Séquence, structure et mécanisme réactionnel
18C'est au début des années 1980 que les premières lipases et estérases ont été purifiées et caractérisées au point de vue biochimique. A ce jour, plusieurs centaines de séquences sont répertoriées dans les bases de données telles que Swiss-Prot (http://www.expasy.org). Comme il a déjà été mentionné précédemment, les lipases sont des enzymes très variables de par leurs origines et leurs spécificités de substrat. Les plus petites ont des masses moléculaires de 20-25 kDa tandis que les plus grosses ont des masses moléculaires de 60-65 kDa (Cygler et al., 1999). Les premières structures cristallographiques publiées ont été celle de la lipase du champignon filamenteux Rhizomucor miehei (Brady et al., 1990) et celle de la lipase pancréatique humaine (Winkler et al., 1990). Depuis lors, ce sont plus de 60 structures tridimensionnelles qui sont accessibles au NCBI (http://www.ncbi.nlm.nih.gov/). Bien que les séquences peptidiques montrent très peu de similitude entre elles, principalement en raison de l'hétérogénéité de leur origine, les lipases présentent dans l'ensemble la même structure tridimensionnelle (Ollis et al., 1992 ; Derewenda, 1994). Différents travaux ont cependant permis le regroupement des lipases en sous-familles en fonction de leurs origines et de leurs rôles physiologiques respectifs (Anthonsen et al., 1995 ; Drablos et al., 1997 ; Arpigny et al., 1999). Cependant, la découverte constante de nouvelles lipases ainsi que leurs caractérisations conduiront à l'évolution de cette classification. Récemment, l'analyse de la relation séquence–structure–fonction de 1 367 séquences protéiques correspondant aux 806 lipases répertoriées dans la base de données LED (Lipase Engineering Database; http://www.led.uni-stuttgart.de) a permis de les classer en 16 superfamilles et 38 familles homologues (Pleiss et al., 2000 ; Fischer et al., 2003).
3.1. Les α/β hydrolases
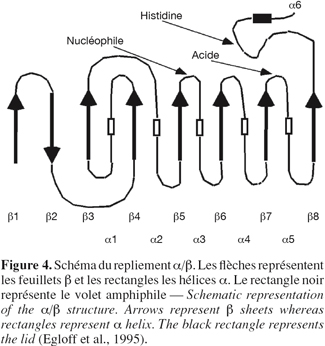
19Le repliement α/β est le motif de base de nombreuses hydrolases telles que les lipases et les estérases mais également l'acéthylcholine estérase, la carboxypeptidase, la diènelactone hydrolase, l'haloalkane déhalogénase. Ces enzymes ont tous en commun un domaine structural central typique formé par 8 brins β connectés par 6 hélices α formant un repliement dit α/β (Ollis et al., 1992). Autour de ce domaine central, viennent se greffer diverses structures peptidiques responsables des propriétés catalytiques de l'enzyme ainsi que de sa spécificité de substrat. Le site catalytique des lipases est constitué d'une sérine, d'une histidine et d'un acide carboxylique (Asp, Glu) dont l'ordre d'apparition dans la séquence primaire est Ser-Asp/Glu-His. De plus, la sérine catalytique est généralement incluse dans le pentapeptide Gly-X1-Ser-X2-Gly où X1 et X2 représentent un acide aminé variable. Ce pentapeptide est, en général, la seule portion de séquence peptidique conservée chez les lipases. La sérine catalytique est toujours située dans un coude nucléophile situé à l'extrémité C-terminale du 5e brin β et immédiatement suivi d'une hélice α (Figure 4). L'histidine de la triade catalytique est située à l'extrémité carboxy-terminale du dernier brin du feuillet constituant le repliement α/β tandis que l'acide carboxylique est généralement situé à l'extrémité du 7e brin, sauf pour la lipase pancréatique où il est situé à l'extrémité du 6e brin (Derewenda et al., 1992 ; Dodson et al., 1992 ; Cygler et al., 1999).
3.2. Mécanisme enzymatique d'hydrolyse
20Le mécanisme enzymatique des lipases montre quelques similitudes avec celui des protéases à sérine active. Contrairement aux autres hydrolases, le site actif des lipases est généralement recouvert d'une boucle peptidique formée par une hélice α amphiphile d'une quinzaine d'acides aminés qui agit comme un volet (lid) (Schrag et al., 1991 ; Derewenda et al., 1992 ; Grochulski et al., 1994) (Figure 4). Lorsque cette hélice α recouvre le site actif, l'enzyme est dans sa forme fermée ou inactive. Dans cette conformation, la face hydrophobe de cette hélice amphiphile est en interaction avec des résidus hydrophobes entourant le site actif tandis que sa face hydrophile interagit avec des molécules d'eau. Le substrat ne peut donc pas être en interaction avec la triade catalytique. Dans la forme active ou ouverte de l'enzyme et suite au mécanisme d'activation interfaciale, il y a un déplacement de l'hélice α constituant le volet. La face hydrophobe de l'hélice orientée auparavant vers l'intérieur du site actif s'expose au solvant, créant une surface hydrophobe supposée interagir avec l'interface eau / corps gras. Le site actif de l'enzyme est dès lors accessible au substrat. La résolution de structures cristallographiques des lipases de R. miehei (Brzozowski et al., 1991), de Geotrichum candidum (Schrag et al., 1993) et de la lipase pancréatique humaine (Winkler et al., 1990 ; Miled et al., 2000) a permis de mettre en évidence l'existence de cette hélice amphiphile recouvrant le site catalytique. Cependant, certaines lipases sont capables d'hydrolyser des lipides en dessous de leur concentration micellaire critique et il a été montré que l'augmentation de leur concentration au-delà de leur CMC n'entraîne pas une brusque augmentation de la lipolyse (Nini et al., 2001). Pour expliquer cette observation, l'hypothèse la plus plausible est qu'il existe, en solution aqueuse, un équilibre entre forme ouverte et forme fermée de l'enzyme et que le passage vers la forme ouverte correspond au déplacement de cette hélice α amphiphile recouvrant le site actif. D'un autre côté, il a été démontré que même en deçà de leur CMC, les molécules de substrat ont tendance à former de petits agrégats (Entressangles et al., 1968) formant dès lors des micelles transitoires pouvant conduire au mécanisme d'activation interfaciale (Fojan et al., 2000 ; Nini et al., 2001). D'autre part, des études cinétiques et structurales d'enzymes lipolytiques telles que la cutinase de Fusarium solani (Martinez et al., 1992), des lipases de Candida antarctica (Martinelle et al., 1995), de Pseudomonas aeruginosa et de Bacillus subtilis (Misset et al., 1994) ainsi que de la lipase pancréatique du cochon d'Inde (Hjorth et al., 1993) ont montré d'une part, qu'elles étaient actives sur des esters carboxyliques partiellement solubles en phase aqueuse (tributyrine, butyrate de p-nitrophényl) et d'autre part, qu'elles ne présentaient pas de mécanisme d'activation interfaciale. Pour certaines de ces enzymes, les analyses cristallographiques ont mis en évidence l'absence d'hélice amphiphile recouvrant le site actif. En conséquence, ces lipases sont plutôt classées comme étant des estérases bien qu'étant capables d'hydrolyser des triglycérides à longues chaînes d'acides gras insolubles en phase aqueuse (Nini et al., 2001).
21Sur la base de données cristallographiques, certains résidus, différents de ceux de la triade catalytique, semblent être importants dans le mécanisme catalytique. Ces résidus forment ce que l'on dénomme le trou de l'oxyanion (oxyanion hole). Leur rôle serait essentiellement de stabiliser des intermédiaires réactionnels, tels que les intermédiaires tétraédriques. Pour la lipase de Humicola lanuginosa, l'azote des fonctions amides de Ser83 et de Leu147 ainsi que le groupement hydroxyle de la Ser83 forment des liaisons hydrogènes avec les intermédiaires tétraédriques. Dans le cas de la lipase de Candida rugosa, ce sont les azotes des fonctions amides des Gly123 et Gly124 ainsi que l'Ala210 qui semblent remplir la même fonction (Beer et al., 1996).
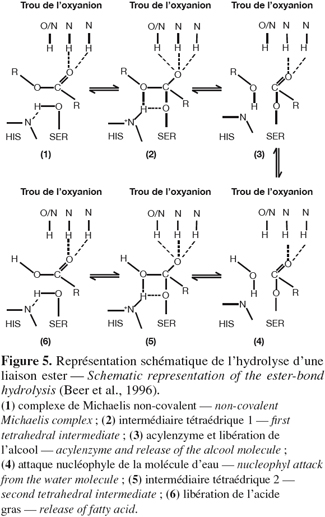
22L'hydrolyse d'un ester carboxylique par la triade catalytique peut se décomposer en six grandes étapes (Figure 5). Tout d'abord, le carbone de la fonction carboxylique du substrat subit une attaque nucléophile du groupement hydroxyle de la sérine dont le caractère nucléophile est augmenté par le résidu histidine suite à la formation d'une liaison hydrogène. L'anneau imidazole de l'histidine devient alors protoné et chargé positivement. Cette charge positive est stabilisée par une charge d'un résidu acide (Asp ou Glu) (1). Il en résulte la formation d'un premier intermédiaire tétraédrique, stabilisé par deux liaisons hydrogènes avec des résidus du trou de l'oxyanion (2). Par la suite, il y a libération d'une molécule d'alcool, formation de l'acyl-enzyme (3) et attaque nucléophile de l'acyl-enzyme par une molécule d'eau (4). Cette seconde attaque nucléophile aboutit à la formation d'un second intermédiaire tétraédrique, stabilisé par le trou de l'oxyanion (5). Finalement, il y a libération de l'acide gras et retour de l'enzyme dans sa conformation initiale (6) (Jaeger et al., 1994 ; Wrinkler et al., 1994 ; Beer et al., 1996).
23Le mécanisme d'action de la lipase pancréatique met en œuvre des phénomènes plus complexes. Une co-lipase est nécessaire pour assurer la fixation de l'enzyme sur le substrat. Le mécanisme d'activation interfaciale est dans ce cas sujet à controverse. En effet, Hermoso et ses collaborateurs ont démontré en 1997 que le système lipase-colipase-micelles (= sels biliaires) est activé dans l'eau avant de rejoindre l'interface (Hermoso et al., 1997).
3.3. Cinétique d'hydrolyse
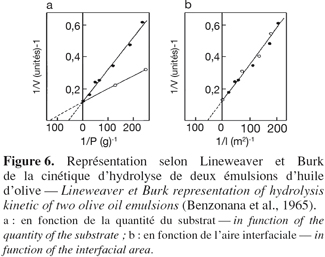
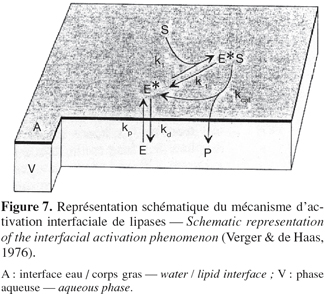
24Il a déjà été mentionné que les lipases agissent sur des composés insolubles en phase aqueuse et que la réaction se déroulait à l'interface eau / corps gras. De ces propriétés atypiques résulte une cinétique d'hydrolyse particulière. La première étape consiste en l'adsorption de l'enzyme à l'interface eau / huile selon un isotherme de Langmuir (Benzonana et al., 1965). La réaction se déroulant dans un système biphasique, la vitesse d'hydrolyse dépend non seulement de la quantité de substrat présent dans le milieu mais également de l'aire interfaciale. En effet, en utilisant deux types d'émulsions d'huile d'olive, une fine et une grossière, les représentations de Lineweaver et Burk montrent deux droites de pentes différentes lorsque l'activité enzymatique est exprimée en fonction de la quantité du substrat et deux droites confondues lorsque l'activité est exprimée en fonction de l'aire interfaciale de l'émulsion (Figure 6). Dans ces conditions, le modèle de Michaelis-Menten, valable en phase homogène, ne peut servir pour décrire la cinétique des lipases. Un modèle en deux étapes plus adapté a été proposé par Verger et de Haas en 1976 (Figure 7). La première étape consiste en une adsorption de l'enzyme à l'interface eau / corps gras. Cette adsorption provoquant l'activation de l'enzyme par déplacement de l'hélice α amphiphile recouvrant son site actif. La seconde consiste en la formation d'un complexe enzyme / substrat qui, après hydrolyse, conduit aux produits de la réaction. Cette seconde étape peut être décrite par un modèle de Michaelis-Menten " interfacial " dans lequel les concentrations en substrat sont exprimées en mole par unité de surface plutôt qu'en mole par unité de volume.
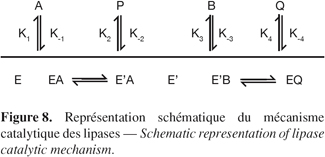
25Le mécanisme décrivant le mieux les cinétiques des réactions catalysées par les lipases est un mécanisme de type Ping-Pong Bi-Bi (Chulalaksananukul et al., 1990 ; Paiva et al., 2000 ; Bousquet-Dubouch et al., 2001). Dans ce mécanisme, il y a dans un premier temps fixation du substrat A sur l'enzyme pour former le complexe EA avec libération du premier produit. Le second substrat nucléophile B se fixe sur le complexe acyl-enzyme E' pour aboutir au complexe E'B. Ce dernier subit un réarrangement pour libérer le second produit Q et l'enzyme E régénéré (Figure 8).
4. Propriétés physico-chimiques des lipases
26Les lipases bactériennes ont en général un pH optimum neutre ou légèrement alcalin (8-8,5) (Lawrence, 1967) tandis que les lipases d'origine fongique ont un pH optimum neutre ou légèrement acide : 6,5 pour celle de Geotrichum candidum (Veeraragavan et al., 1990) ; 5,6 pour celle de Rhyzopus delemar (Iwai et al., 1974). Cependant, il existe des lipases conservant une bonne activité à des pH plus extrêmes. Celles de Pseudomonas fragi (Watanabe et al., 1977), Mucor javanicus (Roblain et al., 1989) ont un pH optimum situé entre 8 et 10 tandis que celle de Torulopsis sp. (Waller et al., 1987) conserve 80 % de son activité à pH 3. D'autre part, certaines lipases sont stables et actives dans une large gamme de valeurs de pH. La lipase de Pseudomonas cepacia conserve 100 % de son activité après incubation durant 24 h à 30 °C pour une gamme de pH variant de 3 à 11 (Sugihara et al., 1992) tandis que celle de Fusarium heterosporum est stable dans une gamme de pH variant de 4 à 10 (Shimada et al., 1993).
27La température optimale des lipases est souvent comprise entre 30 et 40 °C. En général, les lipases d'origine végétale ou animale sont peu thermostables contrairement aux lipases microbiennes. En effet, Humicola lanuginosa produit une lipase dont l'activité optimale est de 45 °C (Che Omar et al., 1987) tandis que pour certaines souches de P. fragi, elle est de 75 °C (Watanabe et al., 1977). D'autres lipases sont adaptées aux plus basses températures. C'est le cas de celle d'Aspergillus niger qui a une température optimale de 25 °C (Fukomoto et al., 1964), ainsi que celle de Pseudomonas fluorescens qui possède encore 30 % de son activité maximale à 1 °C (Papon, 1989).
5. Spécificité des lipases
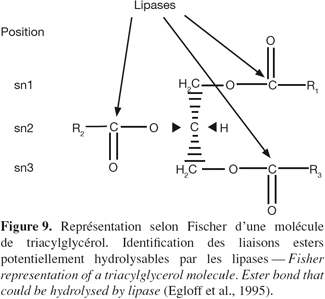
28Certaines lipases hydrolysent indifféremment tous types de liaisons ester des triglycérides, ne faisant pas de discrimination entre leurs positions dans la molécule. Ce sont par exemple les lipases de Penicillium expansum (Stocklein et al., 1993) et de P. cepacia (Sonnet et al., 1993). Par contre, d'autres lipases sont spécifiques de la position de ce lien ester au sein de la molécule (Figure 9). Ce lien ester peut être situé sur le carbone 1 (sn1) du glycérol, sur le carbone sn2 ou sur le carbone sn3. Les lipases de Staphylococcus aureus, Staphylococcus acnes et de Chromobacterium viscosum hydrolysent indifféremment les positions sn1, sn2 ou sn3 tandis que celles de P. fragi et de Pseudomonas geniculata sont spécifiques des positions sn1 et sn2. Les lipases de Pseudomonas glumae et de P. fluorescens semblent quant à elles être spécifiques de la position sn2 (Jaeger et al., 1994). Les lipases peuvent être également spécifiques vis-à-vis de l'acide gras. La lipase de G. candidum est spécifique des acides cis-9 insaturés et celle de Penicillium roqueforti des acides gras à courte chaîne (Egloff et al., 1995). Certaines lipases ont même des propriétés stéréospécifiques. En effet, de nombreux exemples de l'aptitude des lipases à distinguer des énantiomères ont été décrits dans la synthèse d'esters à propriétés aromatiques (Engel, 1992 ; Lutz et al., 1992).
6. Applications industrielles
29Les lipases microbiennes sont souvent perçues comme une des plus importantes et des plus intéressantes classes d'enzymes pour le monde industriel. Cet intérêt provient principalement du fait d'une part, que les lipases possèdent des propriétés catalytiques atypiques et que d'autre part, les technologies à mettre en œuvre pour les produire sont relativement simples. La plupart des lipases microbiennes sont stables dans de nombreux solvants organiques et ne requièrent pas de co-facteur pour être actives. On peut les utiliser en tant qu'hydrolase ou comme catalyseur en synthèse organique. Elles présentent une large gamme de spécificité de substrat et une grande énantiosélectivité. Leurs domaines d'applications sont donc très vastes et variés. Nous n'en présentons ici que quelques-uns.
6.1. Les lipases en tant qu'hydrolases
30Dans l'industrie agro-alimentaire, les lipases sont couramment utilisées en boulangerie, en biscuiterie, en chocolaterie, dans la fabrication de produits laitiers ou fermentés. Elles interviennent dans la maturation des fromages et de certaines charcuteries (saucissons, salamis). L'hydrolyse de la matière grasse conduit, en fonction de la spécificité de l'enzyme utilisé, à la libération d'acides gras à courte chaîne (C4-C6) ou à plus longue chaîne (C12-C14), ce qui donne des arômes plus ou moins forts au produit. Les lipases sont également utilisées dans l'interestérification d'huiles et de graisses pour produire des acylglycérols modifiés, impossibles à obtenir par des procédés de synthèse chimique conventionnels. Des travaux antérieurs menés au laboratoire ont permis de développer un procédé d'enrichissement d'acylglycérides en acide γ-linolénique à partir d'huile de bourrache (Destain, 1998). L'acide γ-linolénique étant le précurseur de l'acide dihomo-γ linolénique conduisant à la synthèse d'icosanoïde cyclique (prostaglandines, prostacycline, tromboxane) et linéaire (acides gras hydroxylés et leucotriènes).
31Depuis l'émergence des détergents dits biologiques, l'industrie des détergents représente un marché des plus importants pour l'utilisation des lipases. L'exemple le plus connu est celui de la lipolase commercialisée par la firme Novo Nordisk. Il s'agit de la lipase de Humicola lanuginosa qui est surexprimée dans Aspergillus oryzae. La lipolase est utilisée dans les poudres à lessiver, dans les détergents pour lave-vaisselle et dans les détergents industriels.
32Les lipases sont également couramment utilisées en tannerie. Avant le tannage, les peaux sont lavées dans des bains alcalins (pH 8-13) en présence de lipases de façon à pouvoir éliminer les graisses sous cutanées. L'utilisation de lipases permet de diminuer la quantité de surfactant et de détergent à utiliser dans les bains de lavage, ce qui contribue à l'obtention de peaux plus souples et plus élastiques (Rhom, 1992).
33Les lipases sont également utilisées en environnement et en bioremédiation. Les effluents des industries agro-alimentaires sont souvent riches en lipides et en graisses, ce qui peut entraîner le colmatage des canalisations. L'addition de lipases ou la culture dans ces effluents de microorganismes les produisant, permet d'en réduire la charge en lipide. Par exemple, le Combizym®, commercialisé par la firme Biocatalysts Ltd, est un mélange d'enzymes hydrolytiques (lipases, protéases) et de starter microbien. En bioremédiation, les lipases sont utilisées lors du traitement de sols contaminés par des hydrocarbures (Kim et al., 2002).
6.2. En synthèse organique
34Les lipases sont des catalyseurs très largement utilisés en synthèse organique, principalement en raison de leur stabilité et de leur activité en milieu solvant. De plus, elles présentent une grande chimiosélectivité, régiosélectivité et stéréosélectivité. Dans ce domaine, la plupart des lipases utilisées sont d'origine microbienne.
35Dans l'industrie des cosmétiques et de la parfumerie, les lipases sont utilisées dans la synthèse d'arômes soit par réactions de transestérification comme pour le 3,7-dimethyl-4,7-octadien-1-ol qui présente un arôme de rose (Pandey et al., 1999) ou soit par estérification directe. En effet, de nombreux esters de faibles masses moléculaires tels que l'acétate d'éthyle, l'acétate d'isoamyle sont des constituants d'arômes. Ils sont obtenus à partir de l'alcool et de l'acide correspondant en système non-aqueux en présence de lipases de C. antarctica ou de R. miehei sous forme immobilisée (Gillies et al., 1987 ; Razafindralambo et al., 1994 ; Fonteyn et al., 1995).
36Les esters d'acides gras et de sucres sont des substances amphiphiles pouvant être utilisées comme surfactant non-ionique. Ils présentent les avantages d'être biodégradables, peu toxiques et non allergènes. Leur synthèse par voie enzymatique est une alternative pour la production de molécules intervenant dans la formulation de produits agro-alimentaires, cosmétiques ou détergents. Ducret et collaborateurs ont ainsi mis en évidence les propriétés tensio-actives d'ester de sorbitol et de glucose synthétisés en présence de la lipase de C. antarctica à partir des sucres correspondants, d'acides laurique, caprylique et oléique. D'autre part, Blecker ainsi que Moreau ont étudié la synthèse et les propriétés tensioactives d'esters d'acide gras de longueur de chaînes différentes (Blecker et al., 2002 ; Moreau et al., 2004).
37Les lipases sont largement mises en oeuvre dans l'industrie pharmaceutique pour la synthèse de médicaments ou dans la préparation d'intermédiaire homochiral optiquement actif. C'est le cas de la nikkomycin-B, des anti-inflammatoires non-stéroïdiens, de certains agents antitumoraux, de certains antibiotiques ou vitamines. Par exemple, le naproxène est un anti-inflammatoire non-stéoridien dont l'énatiomère (S) est 28 fois plus actif que l'énatiomère (R). L'utilisation de la lipase de Candida cylindracea permet, par une réaction de transestérification en milieu iso-octane, de résoudre le mélange racémique et d'enrichir le milieu réactionnel en isomère (S) (Cui et al., 1997). Le proglumide est un inhibiteur de la cholecytokinine utilisé dans le traitement de troubles neuropathiques. La lipase de C. cylindracea permet, par réaction d'estérification stéréosélective, d'obtenir le (S)-proglumide butyl ester, forme biologiquement active du proglumide, à partir d'un mélange racémique de N-benzoyl-N', N'-diprolyl-RS-isoglutamine et de butanol en milieu hexane (Muralidhar et al., 2002).
38Les lipases sont également valorisées pour catalyser d'autres réactions que les transestérifications. Les amines primaires sont produites en quantité importante dans l'industrie. Leur application la plus importante concerne les lubrifiants et les agents anti-collants dans les procédés d'extrusion de polymère. Une des amides les plus utilisées pour ces applications est l'oléamide. Elle est produite par une réaction d'amidation entre l'acide oléique et l'ammoniaque catalysée par la lipase de C. antarctica en milieu 2-methyl-2-butanol (Sandoval et al., 2002).
7. Conclusion
39Les lipases sont des enzymes ubiquistes que l'on retrouve aussi bien chez les organismes inférieurs tels que les bactéries, champignons ou levures que chez les organismes supérieurs tels que les plantes et les animaux. Bien que leurs origines et leurs spécificités de substrat soient très variées, le centre catalytique de l'enzyme possède la même architecture tridimensionnelle. Ce qui rend ces enzymes atypiques, c'est qu'elles sont actives aussi bien en phase aqueuse qu'en milieu solvant. C'est pour toutes ces raisons que l'intérêt que portent les scientifiques ainsi que le monde industriel sur l'étude des lipases n'a cessé de croître au cours de ces dernières années.
40Remerciements
41Patrick Fickers a été subventionné par le Fonds pour la formation à la Recherche de l'Industrie et l'Agriculture (F.R.I.A.)
Bibliographie
Adlercreutz P., Gitlesen T., Ncube I. & Read J., 1997. Veronia lipase: a plant lipase with strong fatty acid selectivity. Methods Enzymol., 284, 220-231.
Anthonsen H. et al., 1995. Lipases and esterases: a review of their sequences, structure and evolution. Biotechnol. Annu. Rev., 1, 315-371.
Arpigny J.L. & Jaeger K.E., 1999. Bacterial lipolytic enzymes: classification and properties. Biochem. J., 343, 177-183.
Baba T. et al., 1991. Structure of human milk bile salt activated lipase. Biochemistry, 30, 500-510.
Beer H. et al., 1996. Analysis of the catalytic mechanism of a fungal lipase using computer-aided design and structural mutants. Protein Eng., 6, 507-517.
Beisson F. et al., 2001. Oil-bodies as substrates for lipolytic enzymes. Biochim. Biophys. Acta, 1531, 47-58.
Benzonana G. & Desnuelle P., 1965. Kinetic study of the action of pancreatic lipase on emulsified triglycerides. Enzymology assay in heterogeneous medium. Biochim. Biophys. Acta, 105, 121-136.
Blecker C. et al., 2002. Enzymatically prepared n-alkyl esters of glucuronic acid: the effect of hydrophobic chain length on surface properties. J. Colloid Interface Sci., 247, 424-428.
Borgstrom B., 1975. On the interactions between pancreatic lipase and colipase and the substrate, and the importance of bile salts. J. Lipid Res., 16, 411-417.
Borgstrom B. & Erlanson C., 1973. Pancreatic lipase and co-lipase. Interactions and effects of bile salts and other detergents. Eur. J. Biochem., 37, 60-68.
Bousquet-Dubouch M.P. et al., 2001. Alcoholysis catalyzed by Candida antarctica lipase B in a gas/solid system obeys a Ping Pong Bi Bi mechanism with competitive inhibition by the alcohol substrate and water. Biochim. Biophys. Acta, 1550, 90-99.
Brady L. et al., 1990. A serine protease triad forms the catalytic centre of a triacylglycerol lipase. Nature, 343, 767-770.
Brzozowski A. et al., 1991. A model for interfacial activation in lipases from the structure of a fungal lipase-inhibitor complex. Nature, 351, 491-494.
Canaan S., Roussel A., Verger R. & Cambillau C., 1999. Gastric lipase: crystal structure and activity. Biochim. Biophys. Acta, 1441, 197-204.
Che Omar I., Hayashi M. & Nagai S., 1987. Purification and some properties of a thermostable lipase from Humicola lanuginosa. Agric. Biol. Chem., 51, 37-45.
Chulalaksananukul W., Condoret J.S., Delorme P. & Willemot R.M., 1990. Kinetic study of esterification by immobilized lipase in n-hexane. FEBS Lett., 276, 181-184.
Cui Y., Wei D. & Yu J., 1997. Lipase-catalyzed esterification in organic solvent to resolve racemic naproxen. Biotechnol. Lett., 19, 865-868.
Cygler M. & Schrag J.D., 1999. Structure and conformational flexibility of Candida rugosa lipase. Biochim. Biophys. Acta, 1441, 205-214.
Derewenda Z., 1994. Structure and function of lipases. Adv. Protein Chem., 45, 1-52.
Derewenda Z., Derewenda U. & Dodson G., 1992. The crystal and molecular structure of the Rhizomucor miehei triacylglyceride lipase at 1.9 A resolution. J. Mol. Biol., 227, 818-839.
Destain J., 1998. Production, purification et caractérisation de la lipase de Yarrowia lipolytica. Thèse de doctorat : Faculté Universitaire des Sciences Agronomiques de Gembloux (Belgique).
Dodson G., Lawson D. & Winkler F., 1992. Structural and evolutionary relationships in lipase mechanism and activation. Faraday Discuss., 93, 95-105.
Drablos F. & Petersen S., 1997. Identification of conserved residues in family of esterase and lipase sequences. Methods Enzymol., 284, 28-61.
Ducret A., Giroux A., Trani M. & Lortie R., 1996. Characterisation of enzymatically prepared biosurfactant. J. Amer. Oil Chem. Soc., 73, 109-113.
Egloff M.P. et al., 1995. Crystallographic study of the structure of colipase and of the interaction with pancreatic lipase. Protein Sci., 4, 44-57.
Eijkmann C., 1901. Über Enzyme bei Bakterien und Schimmelpilzen. Zentralbl. Bakt. Parasitenkd. Infektionskr., 29, 841-848.
Engel L., 1992. Lipases: useful biocatalysts for enantioselective reactions of chiral flavor compounds. In: Teranishi R., Takeaka G.R. & Guntert M., eds. Flavor precursors: thermal and enzymatic conversions. ACS Symposium series 490. Washington, DC, USA: American Chemical Society, 20-31.
Entressangles B. & Desnuelle P., 1968. Action of pancreatic lipase on aggregated glyceride molecules in an isotropic system. Biochim. Biophys. Acta, 159, 285-295.
Farmer E. & Ryan C.A., 1992. Octadecanoid precursors of jasmonic acid activate the synthesis of wound-inducible proteinase inhibitors. Plant Cell, 4, 129-134.
Fischer M. & Pleiss J., 2003. The lipase engineering database: a navigation and analysis tool for protein families. Nucleic Acids Res., 31, 319-321.
Fojan P., Jonson P., Petersen M. & Petersen S.B., 2000. What distinguishes an esterase from a lipase: a novel structural approach. Biochimie, 82, 1033-1041.
Fukomoto J., Iwai M. & Tsujisaka Y., 1964. Studies on lipase. IV: Purification and properties of a lipase secreted by Rhyzopus delemar. J. Gen. Appl. Microbiol., 10, 257-265.
Gillies B., Yamazaki H. & Armstrong D., 1987. Production of flavour ester by immobilized lipase. Biotechnol. Lett., 9, 709-714.
Girbes T. et al., 1996. Recent advances in the uses and applications of ribosome-inactivating proteins from plants. Cell Mol. Biol., 42, 461-471.
Grochulski P., Li Y., Schrag J. & Cygler M., 1994. Two conformational states of Candida rugosa lipase. Protein Sci., 3, 82-91.
Hassanien F. & Mukherjee J., 1986. Isolation of lipase from germinating oilseeds for biotechnological process. J. Am. Oil Chem. Soc., 63, 893-897.
Hermoso J., 1997. Neutron crystallographic evidence of lipase-colipase complex activation by a micelle. Embo J., 16, 5531-5536.
Hills M., Kiewitt I. & Mukherjee K., 1989. Enzymatic fractionnement of evening primerose oil by rape lipase: enrichment of γ-linolenic acid. Biotechnol. Lett., 11, 629-632.
Hills M.J. & Mukherjee K.D., 1990. Triacylglycerol lipase from rape (Brassica napus) suitable for biotechnological purposes. Appl. Biochem. Biotechnol., 26, 1-10.
Hjorth A. et al., 1993. A structural domain (the lid) found in pancreatic lipases is absent in the guinea pig (phospho)lipase. Biochemistry, 32, 4702-4707.
Iwai M. & Tsujisaka Y., 1974. The purification and the properties of three kinds of lipase from Rhizopus delemar. Agric. Biol. Chem., 38, 1241-1247.
Jaeger K.E. et al., 1994. Bacterial lipases. FEMS Microbiol. Rev., 15, 29-63.
Kim S. & Svetashev V., 2002. Application of Yarrowia lipolytica for oil bioremediation and monitoring of its activity using phospholipid fatty acid analysis. In: Proc. 3rd Yarrowia lipolytica international meeting: cell biology and biotechnology of a nonconventional yeast, 20 July 2002, University of Technology, Dresden, Germany. Dresden, Germany: University of Technology.
Lawrence R., 1967. Microbial lipases and related esterases. Dairy Sci. Abstr., 29, 1-8.
Lombard S., Helmy M.E. & Pieroni G., 2001. Lipolytic activity of ricin from Ricinus sanguineus and Ricinus communis on neutral lipids. Biochem. J., 358, 773-781.
Longhi S. & Cambillau C., 1999. Structure-activity of cutinase, a small lipolytic enzyme. Biochim. Biophys. Acta, 1441, 185-196.
Lord J.M., Roberts L.M. & Robertus J., 1994. Ricin: structure, mode of action, and some current applications. FASEB J., 8, 201-208.
Lutz D., Huffer M., Gerlach D. & Schreier P., 1992. Carboxylester-lipase mediated reactions, a versatile route to chiral molecule. In: Teranishi R., Takeaka G. R. & Guntert M., eds. Flavors precursors: thermal and enzymatic conversions. ACS Symposium series 490. Washington, DC, USA: American Chemical Society, 33-45.
Martinelle M., Holmquist M. & Hult K., 1995. On the interfacial activation of Candida antarctica lipase A and B as compared with Humicola lanuginosa lipase. Biochim. Biophys. Acta, 1258, 272-276.
Martinez C. et al., 1992. Fusarium solani cutinase is a lipolytic enzyme with a catalytic serine accessible to solvent. Nature, 356, 615-618.
Miled N., 2003. Importance of the lid and cap domains for the catalytic activity of gastric lipases. Comp. Biochem. Physiol. Part B: Biochem. Mol. Biol., 136, 131-138.
Miled N., De Caro A., De Caro J. & Verger R., 2000. A conformational transition between an open and closed form of human pancreatic lipase revealed by a monoclonal antibody. Biochim. Biophys. Acta, 1476, 165-172.
Misset O. et al., 1994. The structure-function relationship of the lipases from Pseudomonas aeruginosa and Bacillus subtilis. Protein Eng., 7, 523-529.
Moreau B. et al., 2004. Synthesis of novel D-glucuronic acid fatty esters using Candida antarctica lipase in ter-butanol. Biotechnol. Lett., 26, 479-486.
Morlon-Guyot J. et al., 2003. Identification of the ricin lipase site and implication in cytotoxicity. J. Biol. Chem., 278, 17006-17011.
Muralidhar R. et al., 2002. Resolution of (RS)-proglumide using lipase from Candida cylindraceae. Bioorganic Med. Chem., 10, 1471-1475.
Nini L. et al., 2001. Lipase-catalysed hydrolysis of short-chain substrates in solution and in emulsion: a kinetic study. Biochim. Biophys. Acta, 1534, 34-44.
Ollis D. et al., 1992. The alpha/beta hydrolase fold. Protein Eng., 5, 197-211.
Pahoja V. & Sethar M., 2002. A review of enzymatic properties of lipase in plants, animals and microorganisms. Pakistan J. Appl. Sci., 2, 474-484.
Paiva A., Balcao V. & Malcata F., 2000. Kinetics and mechanisms of reactions catalyzed by immobilized lipases. Enzyme Microb. Technol., 27, 187-204.
Papon M., 1989. Les activites lipolytiques des bactéries lactiques isolées de viande et de Brochothrix thermoshacta. Clermont-Ferrant, France : Université Blaise-Pascal.
Pleiss J. et al., 2000. Lipase engineering database-understanding and exploiting sequence-structure-relationship. J. Mol. Catal. Part B: Enzymatic, 10, 491-508.
Razafindralambo H. et al., 1994. Improvement of enzymatic synthesis yields of flavour acetates: the example of isoamyl acetate. Biotechnol. Lett., 16, 247-250.
Roblain D., Destain J. & Thonart P., 1989. Improvement of Mucor lipase production by mutant selection. Belg. J. Food Chem. Biotech., 44, 79-82.
Rhom, 1992. German Pattent: DE-4119889.
Sandoval G., Condoret J.S., Monsan P. & Marty A., 2002. Esterification by immobilized lipase in solvent-free media: kinetic and thermodynamic arguments. Biotechnol. Bioeng., 78, 313-320.
Sarda L. & Desnuelle P., 1958. Action de la lipase pancréatique sur les esters en émulsion. Biochim. Biophys. Acta, 30, 513-521.
Schrag J.D. & Cygler M., 1993. 1.8 A refined structure of the lipase from Geotrichum candidum. J. Mol. Biol., 230, 575-591.
Schrag J., Li Y., Wu S. & Cygler M., 1991. Ser-His-Glu triad forms the catalytic site of the lipase from Geotrichum candidum. Nature, 351, 761-764.
Shimada Y. et al., 1993. Purification and characterisation of a novel solvent-tolerant lipase from Fusarium heterosporum. J. Ferment. Bioeng., 75, 349-352.
Sonnet P., Foglia T. & Fearheller S., 1993. Fatty acid selection of lipase: erucic acid from rapeseed oil. J. Amer. Oil Chem. Soc., 70, 387-391.
Stelmach B.A. et al., 2001. A novel class of oxylipins, sn1-O-(12-oxophytodienoyl)-sn2-O-(hexadecatrienoyl)-monogalactosyl diglyceride, from Arabidopsis thaliana. J. Biol. Chem., 276, 12832-12838.
Stocklein W., Sztajer H., Menge U. & Schmid R., 1993. Purification and properties of a lipase from Penicillium expansum. Biochim. Biophys. Acta, 1168, 181-189.
Sugihara A. et al., 1992. Purification and characterization of a novel thermostable lipase from Pseudomonas cepacia. J. Biochem., 112, 598-603.
Tan M. & Niessen L., 2003. Analysis of rDNA ITS sequences to determine genetic relationships among, and provide a basis for simplified diagnosis of, Fusarium species causing crown rot and head blight of cereals. Mycol. Res., 107, 811-821.
Tsuchiya T. et al., 1999. Cloning of chlorophyllase, the key enzyme in chlorophyll degradation: finding of a lipase motif and the induction by methyl jasmonate. Proc. Natl Acad. Sci. USA, 96, 15362-15367.
Veeraragavan K., Colpitts T. & Gibbs B.F., 1990. Purification and characterization of two distinct lipases from Geotrichum candidum. Biochim. Biophys. Acta, 1044, 26-33.
Verger R. & de Haas G.H., 1973. Enzyme reactions in a membrane model. 1. A new technique to study enzyme reactions in monolayers. Chem. Phys. Lipids, 10, 127-136.
Verger R. & de Haas G.H., 1976. Interfacial enzyme kinetics of lipolysis. Ann. Rev. Biophys. Bioeng., 5, 77-117.
Waller W. & Comeau L., 1987. Caractéristiques et performances d'une lipase fongique acido-résistante. Etud. Rech., 3, 205-212.
Warden C. et al., 1993. Chromosomal localization of lipolytic enzymes in the mouse: pancreatic lipase, colipase, hormone-sensitive lipase, hepatic lipase, and carboxyl ester lipase. J. Lipid Res., 34, 1451-1455.
Watanabe N., Ota Y., Minoda Y. & Yamada K., 1977. Isolation and identification of alcaline lipase producing microorganisms, cultural conditions and some properties of crude enzyme. Agric. Biol. Chem., 41, 1353-1358.
Winkler F.K., D'Arcy A. & Hunziker W., 1990. Structure of human pancreatic lipase. Nature, 343, 771-774.
Wrinkler F. & Gubernator, 1994. Structure and mecanism of human pancreatic lipase. In: Wooley P. & Pettersen S., eds. Lipase. Cambridge, UK: Cambridge University Press, 23-48.
Year H. et al., 2003. Mycetoma of the foot caused by Fusarium solani: identification of the etiologic agent by DNA sequencing. J. Clin. Microbiol., 41, 1805-1808.
Pour citer cet article
A propos de : Patrick Fickers
Université de Liège. Centre Wallon de Biologie Industrielle. Service de Technologie Microbienne. Boulevard du Rectorat, Bâtiment 40. B-4000 Liège (Belgique).
A propos de : Jacqueline Destain
Gembloux Agricultural University – FUSAGx. Centre Wallon de Biologie Industrielle. Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : destain.j@fsagx.ac.be
A propos de : Philippe Thonart
Université de Liège. Centre Wallon de Biologie Industrielle. Service de Technologie Microbienne. Boulevard du Rectorat, Bâtiment 40. B-4000 Liège (Belgique) – Gembloux Agricultural University – FUSAGx. Centre Wallon de Biologie Industrielle. Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgique).





